
1、下列属于物理变化的是( )
A.冰雪融化 B.金属锈蚀 C.高炉炼铁 D.煤气燃烧
23.煤是重要的化工原料,用煤做燃料,不仅是极大的浪费,而且因煤烟中含有硫的化合物(如FeS2),燃烧时生成SO2气体造成环境污染。
设某具有30万户人口的中等城市,每户每天烧煤5千克,这种煤中含FeS25%,燃烧时,设有90%的硫转化为二氧化硫,被排放入大气之中。
硫铁矿燃烧时的反应方程式为4FeS2+11O2=2Fe2O3+8SO2,问:
⑴燃烧1吨煤,可产生多少千克的SO2?
⑵该中等城市,如果全部以上述的煤做燃料,每年将有多少吨二氧化硫排放到大气中?
22.锌粉、铝粉、铁粉、镁粉的混合物a克与一定质量的溶质质量分数为25%的稀硫酸恰好完全反应,蒸发水分后得固体C(不含结晶水)b克。求反应过程生成H2多少克
21.实验设计,自然界矿物中一种重晶石矿的主要成分是BaSO4,它不溶于任何酸、碱和水,纯净的硫酸钡可供医疗等方面应用,课外活动小组同学,用重晶石矿、焦炭为原料,制取纯净硫酸钡。(设矿物中杂质不与焦炭反应,也不溶于水)部分流程如下:

按要求填空:
⑴在步骤①中,哪些元素化合价升高了,哪些元素化合价降低了? 。
⑵写出步骤②中溶液A的溶质的化学式________;
⑶写出利用A溶液制取Ba(OH)2的化学方程式: 。
⑷有同学指出,上述步骤②产生有毒气体H2S,应将方法加以改进,请你提出改进意见,使该实验既不产生H2S,又能获纯净BaSO4。请写有关化学方程式___________________。
20.A、B、C、D、E五种物质都是含二价金属元素X的化合物,它们之间存在下列转化关系,图中H,G,F为另加的试剂。
根据以上关系回答:
⑴ X元素是_______。
⑵写出有关物质的化学式:A__________,B__________,C___________,D__________,
E_________,F__________,G__________, H_________。
⑶写出D→A,E→D,A→E的化学方程式:D→A_____________________________
E→D_____________________________ A→E_____________________________
19.某学生利用大试管、长颈漏斗、量筒、水槽、胶塞(有孔)、玻璃导管、橡皮导管,还有秒表等器材设计一套发生H2实验装置,并用排水集气法将H2吸收于量筒中,用秒表记录反应时间,观察一定时间内产生H2的体积。
请回答下列问题:
⑴画出发生和吸收H2的装置图(铁架台等不画出):
⑵实验记录如下(注:H2的体积已折算为标准状况):
|
时间(分钟) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
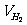 (mL) (mL) |
100 |
160 |
200 |
224 |
224 |
224 |
224 |
224 |
回答:反应的前2分钟内,每分钟平均产生H2的体积是___________mL,反应的前4分钟内每分钟产生H2的体积是____________mL。
⑶已知65g锌与足量盐酸反应,能产生22.4L H2(标准状况)。上述实验中加入的10g盐酸中反应后只用去一半,则反应的锌为________g,原盐酸中溶质的质量分数为________。
18.钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注,常温下钛不和非金属、强酸反应,红热时,却可与许多常见非金属单质反应,钛是航空、宇航、军工、电力等方面的必需原料,地壳中含钛矿石之一称金红石(TiO2),目前大规模生产钛的方法是:
第一步,金红石、炭粉混合在高温条件下通入氯气制得TiCl4和一种可燃性气体,该步发生的反应的化学方程式是: ,该反应的还原剂是_______。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
⑴此反应的化学方程式_____________________________;
⑵如何由上述所得产物中获得纯净金属钛?简述主要实验步骤并写出有关反应的化学方程式________________________________。
17.某同学欲检验NaOH粉末中是否混有Na2CO3,他设计了三个实验方案如下:
|
|
方 案 |
结 论 |
你对实验方法和结论的评价 |
|
方案1 |
样品溶于蒸馏水,把pH试纸投入溶液中,若pH大于7 |
混有Na2CO3 |
|
|
方案2 |
取少量样品溶于蒸馏水后滴入CuSO4溶液,有蓝色沉淀出现 |
混有Na2CO3 |
|
|
方案3 |
取少量样品溶于蒸馏水后滴入足量BaCl2溶液,有白色沉淀 |
混有Na2CO3 |
|
16.岩石、矿物的结构复杂,其成分可用氧化物的化学式来表示,如硅酸钙CaSiO3可表示为CaO·SiO2。试用氧化物的化学式表示下列矿物的成分:
⑴棉花:CaMg3Si4O12________________;⑵白云母:K2Al6Si6(OH)8O18 _____________。
15.CO和O2在催化剂和加热条件下,很容易发生下列反应:
又已知标准状况下22.4cm3CO2与足量的饱和澄清石灰水作用可生成CaCO3 100mg。
现针筒内贮有200cm3CO2、CO、O2的混合气体,(已折算成标准状况)。假设其中CO2为xcm3,CO为ycm3,其余为O2(过量)
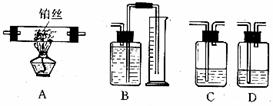
某校初三化学实验小组利用以下实验仪器,组装成一套实验装置,用来测定混合气体中各气体的体积:
请回答下列问题:
⑴从针筒压出的气体,从左到右流过的装置连接顺序应该是:________(用A、B、C、D表示)。
⑵吸收瓶C和D中所盛的吸收溶液是足量的________溶液,装置B中所盛可以是______。
⑶实验完毕后,在装置B量筒中液体的体积约为_____________cm3(用含x,y的式子表示)。
⑷在⑴装置中,从左数第一个吸收瓶中产生的CaCO3质量约为_________mg;第二个吸收瓶产生的沉淀质量约为________mg。(用含x或y的式子表示)。
⑸如果第一个吸收瓶[在⑴装置中]中得到200 mg CaCO3沉淀,第二个吸收瓶得到150mg沉淀,则原混合气体中含CO2的体积为________cm3,;含O2________cm3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com