
35.从含有大量硫酸亚铁、少量硫酸铜以及不溶性杂质的工业废水中回收金属铜并获得硫酸亚铁晶体,操作步骤和目的如下表,请填出表中未完成部分。
|
操作步骤 |
目 的 |
|
(1)将废水过滤 (2)向滤液中加入过量铁粉 (3) (4)在过滤后的固体混合物中加入过量稀硫酸 (5)将反应后的混合物过滤 (6) |
(1) (2) (3)将Cu和过量的铁粉与FeSO4溶液分离 (4) (5) (6)得到硫酸亚铁晶体 |
34.在某氢氧化钙稀溶液中滴入2~3滴酚酞试液,溶液呈现红色。将此溶液在空气中露置一段时间后,发现红色消失了。请你对此现象作出合理的解释,通过实验证明自己的观点。
|
红色消失的原因 |
验证方法 |
实验现象 |
结论 |
|
|
|
|
|
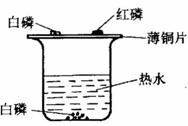
33.小浪用右图所示装置探究可燃物燃烧的条件。他发现热水中的白磷熔化成一
白色小液滴,不久,铜片上的白磷开始燃烧,而红磷及水中的白磷都不燃烧。请回答:
(1)可燃物燃烧需要同时满足的条件是 :
(2)白磷具有的物理性质是 :
(3)实验完毕,小浪将烧杯中的热水慢慢倒出,水快倒完时,小浪发现白磷刚露出峦面就剧烈燃烧起来,请解释该现象 写出白磷燃烧的化学方程式 ;
(4)通常保存少量白磷的方法是 。
32.判断正误(正确的在体后括号内画“ √ ”,错误的画“ Ⅹ ” )
(1)用漏斗过滤时,将液体沿漏斗壁倒入过滤器。( )
(2)如果酸流到桌子上,应立即加适量的碳酸氢钠来中和。( )
(3)生石灰中混入少量碳酸钙,应加入适量的稀盐酸除去。( )
(4)试管内壁只要没有不溶性固体存在,就算洗干净了。( )
31.已知氯化钠、纯碱在不同温度时的溶解度:
|
温度/℃ 溶解度/g |
0 |
10 |
20 |
30 |
40 |
|
氯化钠 |
35 |
35.5 |
36 |
36.5 |
37 |
|
纯碱 |
6 |
10 |
18 |
36.5 |
50 |
(1)根据表中所给数据,你能获得哪些信息?
(2)生活在盐碱湖附近的人们“夏天晒盐、冬天捞碱”。你能说出其中的原因吗?
30.某学习小组的同学,欲在不使用酸碱指示剂的条件下,通过添加试剂的方法将含有盐酸的氯化钙溶液变为中性。甲同学提出选用石灰石粉末,乙同学提出选用澄清的石灰水。比较甲、乙两同学所选试剂,你认为 同学的选择不可行;理由是:该试剂虽然能除去原混合液中的 ,但 。
29.请你简要分析下列实验出现异常现象的原因:
(1)点燃氢气时发生爆炸_______________________________
(2)蒸发氯化钠溶液时液滴飞溅_______________________________
28.实验证明,含有+3价铁元素的化合物,通常具有氧化性,如在FeCl3溶液中,三氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁。试回答下列问题:
⑴该反应的化学方程式可表示为 。
⑵向上述反应后的溶液中加入过量的锌粉充分反应后过滤,则滤纸上一定有的固体是(写化学式) ,滤液中的溶质是 (化学式)。
26.“有其他物质生成“是判断物质发生化学变化的依据。但在实际化学反应中,常常根据反应伴随的现象来确定化学反应是否发生。根据你对化学反应的理解填写下表:
|
实验内容 |
主要实验现象 |
化学方程式 |
|
在盛有硝酸银溶液的试管中,插入一根洁净的铜丝 |
|
|
|
|
有白色沉淀生成 |
|
|
|
|
Fe2O3+6HCl==2FeCl3+3H2O |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com