
18.紫葡萄的表皮上常附着一些浅蓝色的斑点,这是为防治葡萄病喷洒的波尔多液。波尔多液中含有一种有毒的盐,吃之前,应将葡萄浸泡中水中一段时间,这种有毒的盐是
A.高锰酸钾 B.硫酸铜 C.熟石灰 D.硝酸钾
17.今年4月18日,我国进行了第5次火车提速。为适应提速要求需把短轨连成长轨。工人常用2Al+Fe2O3高温Al2O3+2Fe这一反应使生成液态铁进行焊接。下列说法不正确的是
A .Al2O3为氧化物 B.该反应为置换反应
C.该反应为复分解反应 D.该反应为放出大量热
16.2008年北京奥运会主会场--国家体育场“鸟巢”的主体为钢结构,钢属于
A.复合材料 B.无机非金属材料 C.合成材料 D.金属材料
15.公安干警在缉毒行动中,训练有素的缉毒犬屡建奇功,它可以嗅出毒品的原因是
A.分子在不断运动 B.分子是可分的
C.分子体积极小 D.分子间有空隙
14.2006年12月17日晚,我市淮海西路一棉花店突发大火,消防人员用高压水枪喷水灭火,水在灭火中的主要作用是
A.降低可燃物的着火点 B.防止燃烧产物污染空气
C.降低温度到可燃物的着火点以下 D.水分解出不助燃的物质
13.2006年7月1日,青藏铁路正式通车,许多旅客乘车穿越青藏高原时,会发生高原反应,感到呼吸困难,这是因为高原地区空气里
A.氧气体积分数大大低于21% B.氮气体积分数大大超过78%
C.氧气体积分数仍约为21%,但空气稀薄 D.CO2气体含量大大增多
12.当你站在电视机背后时,常能闻到一股特殊的气味,散发出这种气味的物质是臭氧(O3),氧气在放电的条件下可以转化为臭氧,下列与此相关的说法中正确的是
A.该变化是化学变化 B.氧气属于化合物
C.该变化是物理变化 D.臭氧星混合物
11.2006年12月15日,徐州通过了国家环保模范城市考核验收。为了更好的把徐州建设为生态优良,环境优美的现代化城市,你认为下列措施不可行的是
A.使用清洁能源代替煤和石油产品
B.实施绿化工程,防治扬尘污染
C.使用燃煤脱硫技术、防治SO2污染
D.分类回收垃圾,并露天焚烧
28.(16分)全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。下面是对铁的腐蚀条件及铁锈组成的探究。
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验。
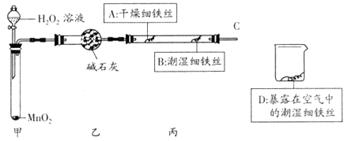
(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接入到装有水的烧 杯中,微热甲装置,说明气密性良好的现象是 。
(2)反应开始后,甲装置中反应现象是 ,MnO2的作用 。
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮。该实验说 明铁生锈主要与 和 有关。B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是 。
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3·H2O,还含有少量的FeCO3。某兴趣小组设计如图装置测定锈铁钉的组成。取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少。该过程中仅考虑发生:Fe2O3·H2O Fe2O3+H2O↑,FeCO3
Fe2O3+H2O↑,FeCO3 FeO+CO2↑,且不需要考虑装置中空气对本实验的影响。(碱石灰成分:CaO和NaOH固体混合物。物质的相对分子质量:Fe2O3·H2O-178,FeCO3-116)
FeO+CO2↑,且不需要考虑装置中空气对本实验的影响。(碱石灰成分:CaO和NaOH固体混合物。物质的相对分子质量:Fe2O3·H2O-178,FeCO3-116)
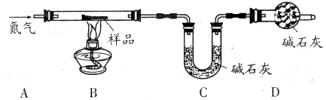
(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水蒸气的总质量为 g,D装置中碱石灰的作用是 。
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为 、 。
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成。
①锈铁钉中Fe2O3·H2O的质量= g。
②锈铁钉中FeCO3的质量= g。
③锈铁钉中单质铁的质量分数= 。
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2? (填“有”或“无”),请通过计算说明。(假设铁在H2SO4和Fe2(SO4)3混合溶液中先发生的反应为:Fe+Fe2(SO4)3==3FeSO4,Fe2(SO4)3的相对分子质量为400)
[计算过程]
27.(9分)味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl(其他成分不考虑)。请回答 下列问题:
(1)味精中至少含有 种元素(填数字)。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是 。(填字母)
A.10 mL B.50 mL C.100 mL
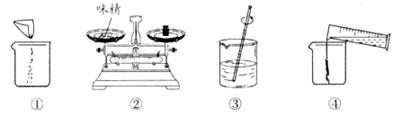
(3)下图是配制过程,正确的操作顺序为 → → → 。 (填序号)
(4)为测定味精中NaCl的质量分数,进行如下实验:
①向所配制的50g溶液中加入过量的AgNO3溶液充分反应(NaCl+AgNO3=AgCl↓+NaNO3),检验沉淀是否完全的方法是:静置后,在上层清液中加入 溶液(填化学式),观察是否有沉淀生成。
②过滤后,洗涤、干燥、称量AgCl固体。洗涤的目的是洗去AgCl固体表面的可溶性杂 质,可溶性杂质中一定有 。
③在其他操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制 溶液的谷氨酸钠质量分数 (填“偏大”、“偏小”或“无影响”),所测定的味精中NaCl的质量分数 (填“偏大”、“偏小”或“无影响”)。
④经精确测定AgCl沉淀质量为2.87g,则该味精中NaCl的质量分数为 。
(有关物质的相对分子质量:NaCl-58.5,AgCl-143.5)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com