
5.在下列溶液中,酸性最强的是
A.pH=0 B.pH=12 C.pH=8 D.pH=1
4.你在家庭厨房里,假若遇到锅里的油着火,应采取的应急措施正确的是
A.立即用嘴吹灭 B.立即往锅里加冷水
C.立即拨打119火警电话 D.立即盖上锅盖
3.加热辰砂(一种矿石)和铁的混合物,完全反应后得到汞和硫化亚铁,则辰砂的组成中一定含有的元素是
A.汞 B.硫 C.汞和硫 D.汞、硫、铁
2.保护环境,研究环保新能源已成为世界关注的课题,近年来,日本推出了一种廉价环保新能源--甲醚,它在空气中完全燃烧时发生如下反府:X+3O2  2CO2+3H2O,则X(甲醚)的化学式为
2CO2+3H2O,则X(甲醚)的化学式为
A.CH4O B.C2H4O C.C2H6O D.C3H6O2
1.根据质量守恒定律判断在化学反应前后,下列诸项中,肯定没有改变的是
①原子的数目 ②分子数目 ③元素的种类④物质的总质量⑤物质的种类⑥原子的种类
A.①②③④⑤⑥ B.①④⑥
C.①③⑤ D.①③④⑥
32.我国某地区有一种“冬天捞碱,夏天晒盐”的说法。这里的“碱”是指Na2CO3,“盐”是指NaCl。这样捞得的“碱”中含有少量NaCl。
某化学课外活动小组为了解释捞碱、晒盐的原理和测定“碱”样品中Na2CO3的含量进行了以下探究。
[查阅资料]
Na2CO3和NaCl的溶解度曲线如图所示.
(1)根据下图回答:
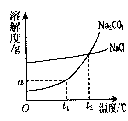
①t1℃时Na2CO3的溶解度为 g;t2℃时Na2CO3的溶解度 (填“<”“>”或“=”)NaCI的溶解度。
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而 (填“增大”“减小”或“不变”)。
③“夏天晒盐”是利用 (填序号)的方法,使NaCl晶体析出。
A.利用风吹日晒,使溶剂蒸发
B.升高温度,使NaCl溶解度增大
[实验步骤]
第一步:称取34.6g“碱”样品。
第二步:将该样品放人l30g稀盐酸中,两者恰好完全反应。其化学方程式为:
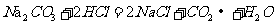
第三步:完全反应后,称得溶液的总质量为151.4g,经计算可知释放出的CO2的
质量为13.2g。
[数据分析]
(2)试计算:(结果保留一位小数)
①Na2CO3的相对分子质量。(1分)
②34.6g“碱”样品中碳酸钠的质量。(2分)
③“碱”样品中Na2CO3的纯度(质量分数)。(1分)
[继续探究]
(3)计算反应后所得溶液中NaCl的质量分数。(4分)
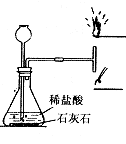
31.通过实验装置的改进,可培养创新精神。图示是经小明同学改进后制取和检验二氧化碳性质的实验简图。
(1)实验现象是接近三通管下口的火柴火焰熄灭,而接近三通管上口的火柴仍在燃烧。由此可判断二氧化碳
具有的性质有:
①物理性质 ;
②化学性质 .
(2)有两瓶无色气体,它们分别是O2和CO2,你如何通过简单的实验将它们区别开来?(简述操作和分析过程)(2分)
30.实验是化学学科的核心内容之一,实验装置的选择、实验操作重在对原理的理解。图示是实验室制取氢气、氧气和二氧化碳三种气体中的某一气体的装置简图。
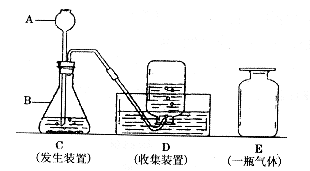
(1)写出标号仪器的名称:
A B 。
(2)D图表示的集气法叫 集气法。
(3)E瓶中装的是由C、D装置制得的气体.该气体是 (填“H2”“O2”或“CO2”),则C装置中的液体物质是 ,固体物质是 。
29.A、B两图分别表示硫、铁丝在氧气中燃烧的示意图。
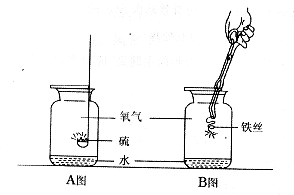
(1)可观察到的实验现象:
A中 ;
B中 。
(2)A中的水是用来吸收产生的二氧化硫,防止 。
(3)B中水的作用是防止 。
28.“观察、分析、归纳”是化学研究的重要步骤。有A、B、C、D四种物质,他们可能是Cu、CuO、CuSO4和FeSO4在小明的实验中可见到它们的踪影。
实验Ⅰ:将黑色粉末A置于试管中,加入20 mL稀硫酸,A完全溶解,得到蓝色溶液B。
实验Ⅱ:向蓝色溶液中加入过量铁粉,充分反应,产生红色固体C和浅绿色溶液D,且反应过程中还有氢气气泡产生。
试帮助小明分析、回答下列问题。
(1)写出下列物质或溶质的化学式:
A. B. C. D. 。
(2)能说明实验I中A与稀硫酸完全反应后,稀硫酸有剩余的实验现象是 。
(3)写出一个反应物中有CuO的置换反应的化学方程式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com