
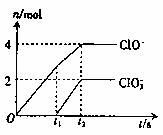
26.(9分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应)。生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。已知,生成C1O3-离子的反应为:
6Ca(OH)2+6C12
5CaC12+Ca(C1O3)2+6H2O。
试回答:
(1)t2时,Ca(C1O)2与Ca(C1O3)2的物质的量之和为 mol,该石灰乳中含有的Ca(OH)2的质量是 g。
(2)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通过氯气的速度不同,C1O-和C1O3-的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后
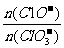 将 2(填“>”“<”或“=”);若
将 2(填“>”“<”或“=”);若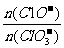 =a,则n(C1-)=
=a,则n(C1-)=
mol(用含a的代数式来表示)。
附加题:本题仅供有有兴趣的同学参考,不计入本次考试的成绩中。
25.(11分)下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是固体金属单质,Y中阳离子与阴离子个数比为2:1 ,化合物X、Y、A、D、E、G的焰色反应为黄色,I是白色沉淀。
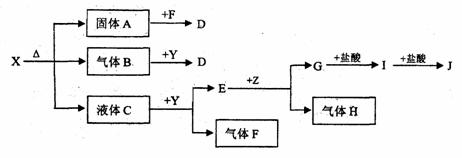
(1)写出X、E、I的化学式。X E I 。
(2)写出Y的电子式 。
(3)关于Y的说法正确的是 。
A.Y是氧化物 B.Y是过氧化物
C.Y是含有非极性键的离子化合物 D.Y是碱性氧化物
(4)写出B和Y反应的化学方程式: 。
(5)X和G的溶液能反应吗?如能反应,写出反应的离子方程式;如不能反应,请说明理由:
六题(共1小题,9分)
24.(14分)某研究性学习小组探究下列化学反应的特征:
(I)KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(Ⅱ)FeS+HNO3→Fe(NO3)3+Fe2(SO4)3+NO2↑+N2O4↑+NO↑+H2O
(Ⅲ)CuSO4→CuO+SO3↑+SO2↑+O2↑
(Ⅳ)CO2+KOH→KHCO3+K2CO3+H2O
⑴大多数化学反应中物质的化学计量数之比是固定的,但上述化学反应的化学计量数之比是不确定的,即物质的化学计量数有多组。根据上述实例,请用一句话归纳化学计量数有多组的化学反应的特点: 。
⑵反应(Ⅱ)中还原产物是 ,若其物质的量之比确定,该反应的化学计量数也随之确定。
⑶有人认为反应(Ⅲ)是两个反应式加合的结果,请分析它是哪两个化学反应加合而成的:______________________________________、_____________________________。
在反应(Ⅲ)中,根据电子转移守恒,物质_______和 的物质的量之比是固定的。
⑷若将16gCuSO4固体粉末按反应(Ⅲ)完全分解,最终气体产物的物质的量的取值范围是: 。
⑸若反应(Ⅳ)中KHCO3、K2CO3的化学计量数分别为a、b,则用a、b表示该反应的化学计量数的化学方程式是 。
23.(12分)胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:①白色结晶状粉末,受热可缓缓分解;②能溶于水,水溶液呈弱碱性;灼烧时火焰为黄色;③遇酸及酸性药物则产生二氧化碳;④患者服用过量,可能引起胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸是中和作用缓慢而持久,可维持3-4小时;
②凝胶本身覆盖于溃疡面上,具有保护作用;③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是 (填化学式);乙中含有的主要化学成份是 (填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:
。
(3)三硅酸镁Mg2Si3O8·nH2O也是常用胃药,被用来治疗胃溃疡,是因为该物质不溶于水,服用后中和胃酸作用持久。把三硅酸镁改写成氧化物形式为:_____ ____。
写出它中和胃酸(胃酸的主要成分是HCl)的化学方程式_____________________。
(4)目前一种新型抗酸剂能迅速改善和缓解胃酸过多的症状,它主要由碳酸镁、氢氧化镁和氢氧化铝组成(说明:Mg(OH)2在高温下分解为MgO)。现按如下步骤测定药剂中三种主要成分的配比:
①取药剂样品,研磨后,加入50mL3.6 mol·L-1盐酸,正好完全反应并收集得到标准状况下224mL气体
②过滤,弃去其中不溶性物质(其余成分不参与反应)
③取②中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4g。
则该药剂中三种主要成分的物质的量之比为n(MgCO3):n(Mg(OH)2):n(Al(OH)3)=_________。
五题(共2小题,25分)
22.(11分)、某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
(1)氯气可以用于漂白、消毒的原因是因为能与水作用形成具有 性的次氯酸,相关反应的离子方程式为 ;
(2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8∶00换水,然后通入氯气消毒,通常游泳池水的含氯量控制在0.5 mg/L至1.0mg/L之间时,效果最好。下图是该小组测定的每天19∶00时泳池中水的氯含量,哪几天使用泳池不安全 ;
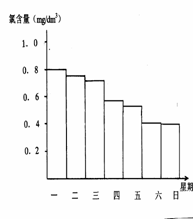
(3)你认为哪几天的天气炎热、阳光强烈 ,说出一种理由是 ;
(4)在对泳池水中通入氯气消毒时,当发生氯气泄漏时,应立即关闭氯气罐,还应采取下列自救方法 。(选填序号)
A、用湿润的毛巾捂住口鼻跑向低处
B、用浸湿小苏打或肥皂水的毛巾捂住口鼻跑向高处
C、用浸湿浓氨水的毛巾捂住口鼻匍匐跑至安全处
D、用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处
(5)小型泳池通常使用漂白液(NaClO溶液)而非氯气来消毒池水,试举出使用漂白液而非氯气的一项理由 ;
(6)请再写出你能知道的能用于饮用水消毒的消毒剂(至少写三种,否则不得分)
请在你书写的药品中选择一种你认为最好的带上飞机,并说明它的原因。
选择 原因
21.(6分)某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了下图1所示的装置。
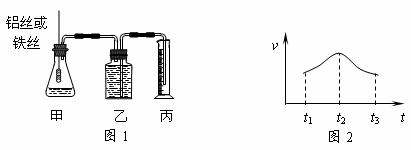
⑴检查图1装置气密性的方法是______________________________________。
⑵若要比较产生气体的快慢,可以测量相同时间内产生气体的体积,也可以测量___________________________________。
⑶实验测得铝丝产生气体的速率(v)与时间(t)的关系如上图2所示,则t1-t2时间内反应速率逐渐加快的主要原因是_______________________________________。
四题(共2小题,23分)
20.(6分)某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示。在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗。为使液体顺利流下,还需插入“空气导入管”与大气相通。
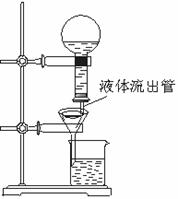
(1)“空气导入管”下口应在____ ,上口应在_______ 。
A.滤纸边沿下方 B.滤纸边沿上方
C.待过滤液液面上 D.待过滤液中
E.A和B项均可 F.C和D项均可
(2)试简要说明自动加液过滤的原理。__________________________
19.某学生用NaHCO3,和KHCO3,组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
|
|
50mL 盐酸 |
50mL 盐酸 |
50mL 盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
则下列分析推理中不正确的是
A.盐酸的物质的量浓度为3.0mol·L
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
|
三题(共2小题,12分)
18.有10 g不纯CaCO3样品与足量盐酸作用后生成4.44 g CO2,且溶液中残留难溶物质。则对于此样品中是否存在①MgCO3 ②K2CO3 ③SiO2杂质的判断正确的是( )
A.肯定含①③,不含② B.肯定含①③,可能含②
C.肯定含②③,不含① D.肯定含②③,可能含①
17.t℃时CuSO4的溶解度是S g,其饱和溶液密度d g.cm-3、物质的量浓度为c mol.L-1。向足量饱和溶液中加入m g无水CuSO4或蒸发掉n g水后恢复t℃,均能获得W g胆矾晶体,下列关系式正确的是( )
A.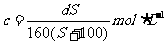 B.
B.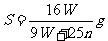
C.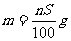 D.
D.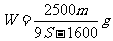
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com