
3.海藻中含有丰富的碘,“2NaI+Cl2=2NaCl+I2”是实验室从海藻中提取碘单质的反应的化学方程式,它属于
A.置换反应 B.分解反应 C.化合反应 D.复分解反应
2.白蚁分泌的蚁酸能蛀蚀木头,蚁酸的化学性质与盐酸相似,能腐蚀很多建筑材料。下列最不容易被白蚁蛀蚀的材料是
A.钢 B.铜 C.大理石 D.铝合金
1.下列有关营养成分与人体健康关系叙述错误的是
A.缺铁易患贫血症 B.为防治佝偻病,过量补钙
C.糖类和脂肪可以提供能量 D.食用蔬菜、水果可以补充维生素
29.为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中都加入了11g样品及足量的水配成溶液;②向三个烧杯中加入质量不等的CaCl2粉末;③将充分反应后生成的沉淀过滤、洗涤、干燥得到 g的白色固体。实验数据如下:
g的白色固体。实验数据如下:
|
|
烧杯Ⅰ |
烧杯Ⅱ |
烧杯Ⅲ |
|
加入CaCl2的质量/g |
5.55 |
12 |
15 |
 /g /g |
5 |
10 |
10 |
回答下列问题:
(1)将烧杯Ⅲ蒸干,得到________g固体,该固体由________和________组成(只填化学式)。
(2)样品中碳酸钠的质量分数是多少?
28.现有一瓶未开启的浓盐酸,试剂瓶标签上的部分内容如下图所示,欲将10mL的浓盐酸稀释为7.3%的稀盐酸,需加水多少克?
|
化学纯 盐酸 含HCl 36.5% 密度 1.18g/ml 容量 500ml |
27.某兴趣小组为证明氢氧化钠溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定氢氧化钠溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明氢氧化钠溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是:______________________。
(2)简述强调“测得的pH小于7”的理由______________________________。
方案二:先在氢氧化钠溶液中滴加几滴酚酞试液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明氢氧化钠溶液与稀盐酸发生了化学反应。该组同学在向氢氧化钠溶液中滴加酚酞试液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞试液,溶液逐渐变成了红色,过了一会儿红色就消失了。该小组同学对这种意外现象的原因做了如下猜想:①可能是酚酞试液与空气中的氧气反应,使红色消失;②可能是酚酞试液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴人酚酞试液。实验中“加热”的目的是____________________,“滴入植物油”的目的是____________________。实验结果证明酚酞试液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取一定量的碳酸钠溶液,在其中滴入酚酞试液,发现溶液也呈红色,由此可以得出以下两个结论:
结论1:说明________ ________________________________;
结论2:说明酚酞试液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:.当氢氧化钠溶液浓度很大时,就会出现上述意外现象。请设计实验证明该方案中取用的氢氧化钠溶液浓度过大:
①实验方法__________________________________________________;
②观察到的现象______________________________________________。
方案三:化学反应中通常伴随能量的变化,可借助反应前后温度的变化判断反应的发生。该组同学将不同浓度的盐酸和氢氧化钠溶液各10mL混合,用温度计测定室温下混合前后溶液温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
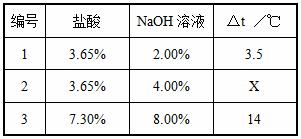
(1)表中X=__________。
(2)某同学在没使用温度计的情况下,通过上图所示装置完成了实验。该同学根据___________________________判断氢氧化钠溶液与稀盐酸发生了中和反应。
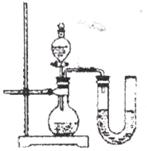
26.下图是化学实验中常用的几种装置。
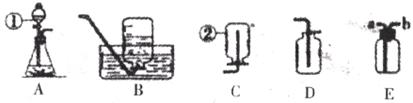
请回答下列问题:
(1)写出有编号的仪器的名称:①__________②__________。
(2)利用上述A、D装置的组合可以制取的一种气体是__________。写出实验室利用此装置制取该气体的反应的化学方程式______________________________。
(3)某同学欲收集一种难溶性气体,认为E装置可以代替B装置。请简述该同学如何利用E装置________________________________________。
25.某固体氧化物X,经过①②两步反应后,得到红色固体单质C,溶液B只含一种溶质,且是盐。反应物和产物均已给出。
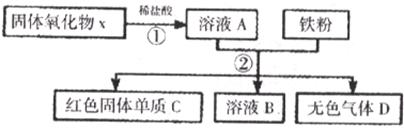
(1)第①步盐酸是否过量?__________,判断根据是_________________________。
(2)写出①中发生反应的化学方程式:______________________________。
(3)写出生成C的化学方程式:______________________________。
24.据媒体透露,顾客反映:某连锁餐饮业“某某豆浆”所提供的油条有氨气的异味。经记者采访,店方承认是用碳酸氢铵和水配成溶液发的面,使油条膨松。以下是记者与“某某豆浆”品控部经理的对话:
记者:“为什么油条有氨气的气味?”
经理:“我们对油条中的碳酸氢铵是定量化标准,对各门店的油条制作采取规范化标准。顾客感到味呛,可能是油温不够所致。因为今天的厨师是生手。”
对稍有化学知识的人来说,经理的话可谓一语道破天机。由以上信息回答:
(1)请把经理所说的话中有科学性错误的写出来。
(2)你可得出碳酸氢铵怎样的化学性质?
(3)传统膨松剂使用的是碳酸氢钠,加热后分解生成碳酸钠、水和二氧化碳。请写出碳酸氢钠分解的化学方程式。
23.在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。为了对废液进行处理,某同学做了如下实验:取废液缸上层清液40mL于烧杯中,逐滴滴入碳酸钠溶液至过量,滴人碳酸钠溶液的质量(x)与有关量的变化关系如下图所示。
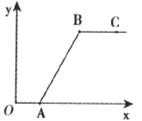
图中纵坐标(y)轴表示__________,OA段发生反应的化学方程式为_______________,反应进行到B点时,溶液中所含溶质是__________,C点溶液的pH__________7。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com