
5.“关爱生命,拥抱健康”是永恒的主题。下列做法不利于人体健康的是
A.多食水果和蔬菜,给人体补充维生素 B.向易变质食品的包装袋中充入氯气
C.胃酸过多的人应少喝汽水 D.用甲醛溶液浸泡海产品,以防其变质
4.正确的化学实验操作对实验结果、人身安全非常重要。下图中的实验操作正确的是
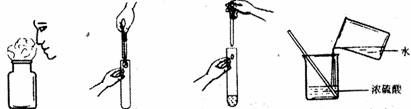
A.闻气体气味 B.取用块状固体 C.滴加液体 D.稀释浓硫酸
3.图表资料可以为我们提供很多信息。下列从图表中获取的信息及应用不正确的是
A.根据金属的熔点数据表,可判断金属的导电性强弱
B.根据金属活动性顺序表,可判断金属是否容易被盐酸腐蚀
C.根据元素周期表,可查找元素的原子序数、元素符号、相对原子质量等信息
D.根据空气质量报告,可知道空气质级别和首要污染物
2.物质的性质决定它的用途,还决定其保存方法。固体KOH具有以下性质:
①白色固体 ②有腐蚀性③易吸收水分④能与空气中的二氧化碳反应。
实验室中必须将它密封保存的主要原因是
A.①② B.③④ C.①③ D.②④
1.小军同学在做家庭小实验时,向热的大米粥中加入碘酒,发现未变蓝色。面对“异常”现象,他不应该采取的做法是
A.向老师请教 B.查找相关资料,探究原因
C.反复实验。并观察是否有相同现象D.认为自己做错了,继续做其它实验
8.家庭食用面碱(主要成分为Na2CO3)中往往混有少量NaCl。李欣同学为测定食用面碱中碳酸钠的含量,设计并进行了以下实验:
①称取面碱样品3.4g于烧杯中,加入20ml水,搅拌至样品全部溶解;
②向其中加入足量的CaCl2溶液,至不再生成沉淀为止;
③过滤并将所得沉淀干燥后,称得质量为3.0g(不考虑操作中的质量损失)。
请计算:食用面碱中Na2CO3的质量分数是多少?(精确到0。1)
6.(1)(6分)下图是实验室制备物质的常用装置,根据装置回答:
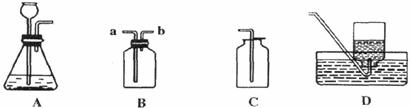
①可用装置A制取的气体有
②装置C可用于收集中① 气体,装置D可用于收集中① 气体,装置B可用于收集中① 气体。
③若用装置B除去二氧化碳中少量的水蒸气,可在装置中装入 ,气体应从 端进入。
(2)(5分)控制变量是科学探究的重要方法之一。小华同学实验中发现:把质量相等的不同物质放入同样一杯水中,有的溶解快,有的溶解多,有的溶解又快又多。是哪些因素影响着物质溶解的快慢与多少呢?
请你参考下表硝酸钾的溶解度随温度的变化关系,以硝酸钾为例,选择一种可能影响硝酸钾溶解快慢的因素设计实验进行探究:
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
溶解度(g) |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
168 |
①影响因素:
②实施方案:
③通过实验得出 。实验中,控制不变的因素是 。
5.(4分)硬水中因溶有较多的可溶性钙、镁化合物,给我们的生活、生产带来许多麻烦。大部分地区的地下水主要含有Ca(HCO3)2、Mg(HCO3)2等物质,可通过加热的方法进行软化。
有些地区的地下水因含有CaCl2、MgCl2,简单的加热方法不能将其软化,可加入过量Ca(OH)2、Na2CO3的将水的Ca2+、Mg2+转变成CaCO3、Mg(OH)2沉淀,从而达到软化的目的。若使这种方法,你认为应先加入 后加 ,其中,除Mg2+时发生的化学反应为 (化学方程式表示)。由于去除Ca2+、Mg2+时加入了过量Ca(OH)2、Na2CO3,使软化后的水具有较强的碱性,使用前需用盐酸调整水的酸碱度,以除去水中残存的 。
4.(3分)向20℃的饱和石灰水中加入少量氧化钙(CaO)粉末,至充分反应(化学方程式为:CaO+H2O===Ca(OH)2+热量).请结合题目信息和下图熟石灰溶解度曲线回答
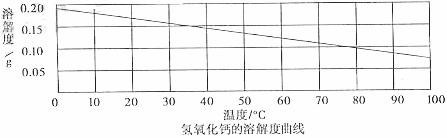
(1)加入氧化钙粉末后,溶液的温度将 (升高、降低或不变);
(2)反应后溶液的质量跟原石灰水相比将会 (增加、减少或不变);
(3)反应后溶液温度恢复至20,跟原石灰水相比,溶质质量分数 (增加、减小或不变)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com