
9、下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个离子方程式表示的是
A.稀盐酸,Na2CO3溶液 B.稀H2SO4溶液,NaAlO2溶液
C.Cu,FeCl3溶液 D.浓氨水,AgNO3溶液
8、为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A.Na2SO3溶液(BaCl2) B.FeCl2溶液(KSCN)
C.KI(淀粉溶液) D.HCHO溶液(石蕊试液)
7、已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO3-→I2 MnO4-→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.H2O2 B.IO3- C.MnO4- D.HNO2
6、在接触法制硫酸的工业生产中,下列生产操作及其原因解释二者都正确的是( )
A.硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧
B.SO2氧化为SO3时需要高压,这样可以提高SO2的转化率
C.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.用98.3%的浓H2SO4吸收SO3,可以防止形成酸雾阻碍SO3的吸收
5、下列反应的离子方程式表示正确的是
A.醋酸钡溶液和硫酸反应:Ba2++SO42-=BaSO4↓
B.硫化钠的第一步水解:S2-+2H2O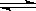 H2S+2OH-
H2S+2OH-
C.甲酸钠溶液和盐酸反应:HCOO-+H+=HCOOH
D.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
4、室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是
A.NH4+、Cu2+、Cl-、NO3- B.K+、Na+、SO32-、S2-
C.K+、Na+、AlO2-、SO42- D.Ba2+、Fe2+、NO3-、Br
3、下列描述中,不符合生产实际的是
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
2、下列说法不正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热反应在常温下不一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定的条件下也能发生
1、下列化工生产过程所发生的反应不属于氧化还原反应的是
A.用油脂制肥皂 B.用铝土矿制金属铝
C.用氯气和消石灰制漂白粉 D.用氢气和氮气合成氨
24.(8分)
取50.0mL Na2CO3和Na2SO4的混合溶液,加入过量的BaCl2溶液,过滤、洗涤并干燥后得到14.51g白色固体;再用过量的稀硝酸处理该白色固体,其质量减少到4.66g。试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度。
(2)在标准状况下产生的气体的体积。
[此题仅普通班做]25.(12分)
有三种质量比可能相同或不同的镁铝合金样品①、②、③。小明、小青、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究。
(1)小明取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为_______________________。
(2)小青取样品②m2 g和足量的稀盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤,洗涤、烘干、灼烧,得到的固体质量仍为m2 g。则样品②合金中镁的质量分数为 。
(3)小红取不同质量的样品③分别和30mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
|
实验序号 |
a |
b |
c |
|
合金质量(mg) |
510 |
765 |
918 |
|
气体体积(mL) |
560 |
672 |
672 |
求:(1)盐酸的物质的量浓度;
(2)合金中镁的质量分数;
(3)在c组实验后,还需向容器中加入1.0mol/L的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
[此题仅强化班做]25.(12分)
有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀。试回答下列问题:
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
|
组别 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
甲 |
B |
|
|
|
|
|
|
|
|
乙 |
D |
|
|
|
|
|
|
|
 (2)请在下列坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液体积(VB/L)变化的曲线。
(2)请在下列坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液体积(VB/L)变化的曲线。
(3)右图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合是:甲 (填化学式)、乙 (填化学式)。
①若实验时取用的乙溶液为500 mL,试计算乙溶液中溶质的物质的量的浓度。
 ②若向500 mL乙溶液中滴加1 000 mL甲溶液时恰好得到bmol(1<b<5)白色沉淀,请计算甲溶液中溶质的物质的量浓度
②若向500 mL乙溶液中滴加1 000 mL甲溶液时恰好得到bmol(1<b<5)白色沉淀,请计算甲溶液中溶质的物质的量浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com