
17、(10分)试回答下列中学化学实验室中常见仪器的有关问题:
(1)在仪器①分液漏斗 ②试剂瓶 ③集气瓶 ④滴瓶 ⑤滴定管 ⑥容量瓶 ⑦量筒
⑧托盘天平中。标有“0”刻度的是(填序号,下同) ,标有使用温度的仪器是 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在仪器①试管 ②分液漏斗 ③容量瓶 ④集气瓶 ⑤酸式滴定管 ⑥碱式滴定中,用到磨砂的有 。
(3)在仪器①漏斗 ②容量瓶 ③蒸馏烧瓶 ④分液漏斗 ⑤烧杯 ⑥蒸发皿中,可用于粗盐提纯实验的有 ,可用于分离两种沸点接近且互不相溶的液态混合物实验的有 。
16、A、B、C分别是元素甲乙丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是 ( )
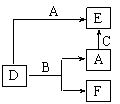 A、D、E中一定都含有A的元素
A、D、E中一定都含有A的元素
B、单质B肯定是氧化剂
C、A、B、C中一定有一种是氧元素的单质
D、若A是非金属,则B一定为金属
15、短周期元素X、Y两种元素,X原子半径小于Y原子半径,两元素可形成X是正价的XY2型化合物,下列关于两元素的叙述正确的是 ( )
A、X、Y可能属于同一周期 B、X是Y的前一周期元素
C、X只能是金属元素 D、X可能是第二周期ⅣA族元素
14、R和Y都是非金属元素,其酸根离子RO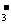 和YO
和YO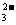 的电子数相等,则下列说法正确的是( )
的电子数相等,则下列说法正确的是( )
①R、Y的阴离子具有相同的电子层结构 ②RO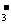 和YO
和YO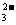 对应的酸都是强电解质
对应的酸都是强电解质
③RO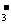 和YO
和YO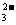 只可能被还原,不可能被氧化 ④R和Y是位于同周期相邻主族的元素
只可能被还原,不可能被氧化 ④R和Y是位于同周期相邻主族的元素
A、①③④ B、①② C、①④ D、③④
13、对下列各种溶液中所含离子的判断合理的是 ( )
A、向无色溶液中加入少量氯水变橙色,溶液中可能含:SO 、Br-、OH-、NO
、Br-、OH-、NO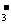
B、在c(H+)=10-14mol·L-1的溶液中可能含:Na+、AlO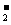 、CO
、CO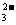 、SO
、SO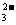
C、某溶液加铝粉有氢气放出,则溶液中可能含:K+、Na+、H+、NO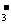
D、使紫色石蕊试液变红色的溶液中可能含:K+、Na+、Ca2+、HCO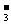
12、下列离子方程式中正确的是 ( )
A、澄清石灰水中通入过量二氧化碳:OH-+CO2=HCO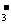
B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C、氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
D、向1mol/L明矾溶液50mL中滴入少量0.1mol/L Ba(OH)2溶液
2Al3++3SO +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
11、在下列叙述中,能说明盐酸酸性比醋酸强的是 ( )
A、将等体积的pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
B、盐酸和醋酸都可以用相应的钠盐与浓硫酸制取
C、相同pH的盐酸和醋酸溶液中分别加入相应的钠盐,固体醋酸的pH变化大
D、相同pH的盐酸和醋酸分别跟锌反应时产生氢气的起始速率相等
10、运用元素周期律分析下面的推断,其中错误的是 ( )
①铍(Be)的氧化物的水化物可能具有两性 ②铊(Ti,第六周期第ⅢA族)既能与盐酸作用产生氢气,又能与NaOH溶液反应放出氢气,Ti(NO3)3溶液的酸性很强 ③砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀酸 ④锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其水溶液是一种强碱 ⑤硫酸锶(SrSO4) (Sr为第五周期第ⅡA族)是难溶于水的白色固体 ⑥硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
A、①②③④ B、②④⑥ C、①③⑤ D、②④⑤
9、以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A、如果5.6L O2含有n个氧分子,则阿伏加德罗常数一定约为4n
B、15.6g Na2O2与过量水反应时,转移电子数为0.4NA
C、9g液态水中含有氢键个数约为NA
D、SiO2晶体中,有NA个Si就4NA个Si-O键
8、在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是 ( )
A、加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B、溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C、先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D、加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com