
3.下列说法中正确的是 ( )
A.能自发进行的反应都是放热反应 B.凡是熵增加的反应一定能自发进行
C.在一定条件下,吸热反应可自发进行 D.放热的熵增加的反应不一定能够自发进行
2.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、
M分子的元素原子序数均小于10,如下图,则下列判断错误的是 ( )
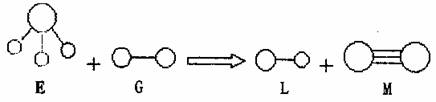
A.G是最活泼的非金属单质 B.L是极性分子
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
1.2005年9月16日(国际臭氧层日),我省签署了“加速淘汰消耗臭氧层物质行动,创建
国家臭氧层友好省倡议书”,向国际社会庄严承诺;提前1年完成我省淘汰CFCs(全氯
氟烃)两类消耗臭氧层的物质。 ( )
A.无氟冰箱是由于使用不含氟的制冷剂,因而是环保型的。
B.我国目前已投入批量生产的哈龙(灭火剂)替代品一七氟丙烷的化学式是C3HF7
C.汽车尾气、超音速飞机排出的废气及工业废气也可以破坏臭氧层
D.人类广泛脾于制致冷剂、喷雾剂、发泡剂、清洗剂的氟氯烃类化学物质是破坏臭氢层的主要原因。
32. (12分)
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1NaOH溶液。所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:
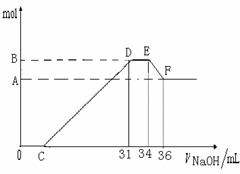
(1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为---------------------------(填化学式)。
(2)完成下列过程中的离子反应方程式:
O→C_______________________________________________________________;
D→E________________________________________________________________;
E→F_______________________________________________________________;
(3)B值是多少mol?写出计算过程。
31.(14分)
根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)反应温度控制在30-35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为
。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
30.(10分)
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
写出其中涉及到的化学方程式:
;
。
(2)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式 。
②反应中生成的氧化产物与还原产物的物质的量之比是 ,
每分解1mol高氯酸铵,转移的电子数目是 。
29.(12分)
第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
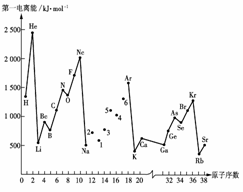
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na--Ar之间六种元素用短线连接起来,构成完整的图像。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是______________;
(3)上图中5号元素在周期表中的位置是________________________________________;
(4)上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:__________________________________。
28.(12分)
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:
2FeSO4
 Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
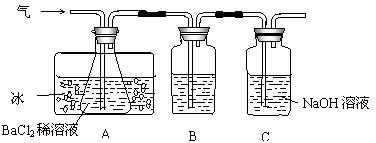 (SO2沸点为-10.02℃)
(SO2沸点为-10.02℃)
请回答相关问题:
(1)A瓶所盛试剂的作用是 ;B瓶所盛的试剂是 ;C瓶所盛试剂的作用是 。
(2)A瓶要用冷水冷却的原因是 。
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则 。(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
理由是 。
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤) 。
27.(10分)实验室用下图的装置将CO2和CO进行分离和干燥.已知a、b均为活塞,试回答
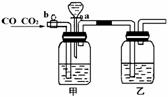
(1)甲瓶中装的是 溶液,乙瓶中装的是 溶液,分液漏斗中装的是 .
(2)当CO2与CO的混和气体通过该装置时,先分离得到的是 ,活塞操作是 ;然后得到 ,活塞操作是 .
26.(10分)
(1)下列有关实验的基本操作及安全知识的叙述,正确的是 (填序号)。
A.附着于试管内壁的苯酚,可用碱液洗涤
B.用结晶法可以除去硝酸钾中混有的少量氯化钠
C.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
D.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
E.浓硫酸不小心沾到皮肤上,立刻用稀烧碱溶液洗涤
F.在氢氧化铁胶体中滴加少量稀硫酸会产生沉淀
(2)下表是某种常见金属的部分性质:
|
颜色状态 |
硬度 |
密度 |
熔点 |
导电性 |
导热性 |
延展性 |
|
银白色固体 |
较软 |
2.70g/cm3 |
660.40C |
良好 |
良好 |
良好 |
将该金属投入冷水中无变化,投人稀盐酸中可产生大量的无色气体。试回答:
①推断该金属可能的一种用途 ,该金属的活动性比铜 (填“强”或“弱”)。
②请自选试剂,设计不同的实验探究该金属与铁的活动性强弱,并完成下表:
|
猜想 |
验证方法 |
预测实验现象 |
|
该金属比铁活泼 |
|
|
|
该金属活泼性比铁弱 |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com