
21. (6分)
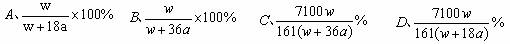
① 在25℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中,进行电解,通电一段时间后,阴极逸出amol气体,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液的质量分数是 (填选项),为确保此实验顺利进行不能使用的一种常见的玻璃仪器是 (填仪器名称)
② 在25℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中,进行电解,通电一段时间后,阳极逸出amol气体,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液的质量分数是 (填选项)
19.(12分)(1)(6分)将洁净金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如下图)。
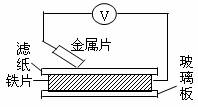
在每次实验时,记录电压表指针的移动方向和电压表的读数如下:

已知构成原电池两电极的金属活泼性相差越大,电压表读数越大。请根据上述记录判断:
①A、B、C、D四块金属片中金属活泼性最强的为 (请用字母表示)。
②若滤纸不用盐溶液浸润而用NaOH溶液浸润,一段时间后,则在滤纸上能看到有白色物质析出,后迅速变为灰绿色,最后变成红褐色。则滤纸上方的金属片为 (请用字母表示),其对应的原电池的正极电极反应式为:
(2) (6分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置则可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
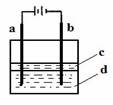
①a电极材料为
②电解液d可以是 ,则白色沉淀在电极上生成;也可以是 ,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
③液体c为苯,在加入苯之前,对d溶液进行加热处理的目的是 。20.(13分)某有机化合物A结构简式如下:
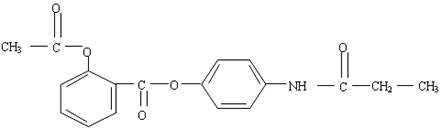
(1)A的分子式是 。
(2)A在NaOH水溶液中充分加热后,再加入过量的盐酸酸化后,可得到B、C、D和
 四种有机物,且相对分子质量大小关系为B>C>D。
四种有机物,且相对分子质量大小关系为B>C>D。
则B、D的结构式分别是:B: , D: 。
(3)下列物质中,不能与B发生化学反应的是(填写序号) 。
①浓H2SO4和浓HNO3的混合液 ②CH3CH2OH(酸催化剂)
③CH3CH2CH2CH3 ④Na ⑤浓溴水
(4)在B的同分异构体中,属于1,3,5,-三取代苯的化合物的结构简式为 。
(5)写出B与碳酸氢钠反应的化学方程式: 。
18.(11分)已知B、D、E是单质。根据下列关系,试回答:
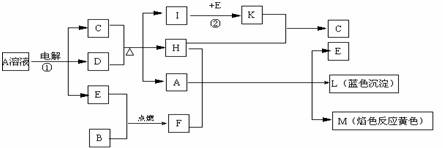
(1)写出下列物质的化学式
A: 、L: 、M ;
(2)反应①的离子方程式: 。
(3)反应②工业上采取的反应条件: ;
17.(10分)下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
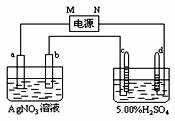
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质的质量为 g。
(3)电源输出电子的物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶ ∶ ∶ 。
(4)AgNO3溶液的浓度(填增大、减小或不变。下同) ,H2SO4溶液的pH 。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。
16.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为 A.0.1mol B.0.2mol C.0.3mol D.0.4mol
第Ⅱ卷(非选择题52分)
15.利尿酸在奥运会上被禁用,其结构简式如图所示.下列叙述正确的是
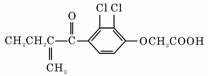
A.利尿酸衍生物利尿酸甲脂的分子式是C14H14Cl2O4
B.利尿酸分子内处于同一平面的原子不超过10个
C.1 mol利尿酸能与7 mol H2发生加成反应
D.利尿酸能与FeCl3溶液发生显色反应
14. 若溶液中由水电离产生的(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
13.加拿大阿尔贡天文台在星际间发现了HC9N链状分子,其结构式为:
CH≡C-C≡C-C≡C-C≡C-C≡N,这是人类发现的最重的星际有机分子,有关该分子的说法不正确的是
A.该物质属于不饱和烃
B.该分子中碳、氮原子最外层电子都满足8电子稳定结构
C.该分子中所有原子都处在一条直线上
D.1mol该物质在一定条件下可与10molH2发生加成反应
12.下列除去括号中杂质的操作中,错误的是
A.乙醇(水) :加CaO蒸馏
B.福尔马林(甲酸) :加Na2CO3固体蒸馏
C.苯(己烯) :加蒸馏水振荡,用分液漏斗分离
D.乙酸乙酯(乙酸) :加饱和Na2CO3溶液,用分液漏斗分离
11.氢氧燃料电池以H2为还原剂,O2为氧化剂,电极为多孔镍,电解液为30%的KOH溶液,下列有关叙述正确的是
①负极反应为4OH--4e-= O2+2H2O
②负极反应为H2+2OH--2e-= 2H2O
③工作时正极区pH升高,负极区pH降低
④工作时溶液中阴离子移向正极
A.③④ B.②③ C.②④ D.①④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com