
6.2007年12月16日,联合国关于保护气候和环境的“巴厘岛宣言”正式签署。为实施这一宣言,我国已在全国范围内开展“节能减排全民行动”。下列有关做法不符合“节能减排”的是 ( )
A.大力采煤,逐步用煤代替石油作能源
B.在汽车上安装汽车尾气催化转化装置,使之发生如下反应: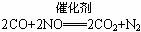
C.在推广使用乙醇汽油的同时,研究开发太阳能汽车和氢氧燃料电池汽车
D.鼓励城市居民步行或骑自行车上下班,尽量减少使用机动车
29.(16分)相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
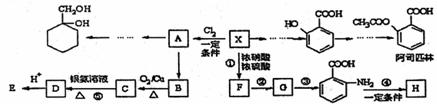
已知:I 
II
请根据所学知识与本题所给信息回答下列问题:
(1)H的结构简式是 ;
(2)反应②的类型是 ;
(3)反应⑤的化学方程式是 ;
(4)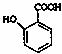 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共
有 种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共
有 种;
(5)主用合成反应流程图表示出由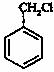 和其他无机物合成
和其他无机物合成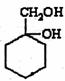 最合理的方案(4步),请在答题纸的方框中表示。
最合理的方案(4步),请在答题纸的方框中表示。
例:
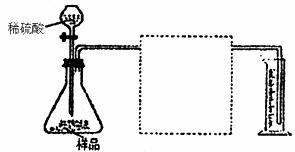
28.(16分)为测定碳酸钙样品(含杂质二氧化硅)的纯度,某兴趣小组的同学设计了如下几个实验方案:
方案I:①称取碳酸钙样品m g ②用c1mol/L盐酸V1mL(过量)溶解样品③取溶解后的溶液体积的十分之一,用c2 mol·L-1NaOH溶液滴定,恰用去V2mL。
方案Ⅱ:①称取碳酸钙样品mg②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为m1 g。
方案Ⅲ:①称取碳酸钙样品mg ②加入足量c1mol·L-1盐酸V1mL(过量)溶解样品③过滤取出滤液 ④在滤液中加入过量c3mol·L-1 Na2CO3溶液V3mL ⑤将步骤④中的沉淀滤出、洗涤、干燥、称重为m2g。
根据以上实验方案,回答以下问题:
(1)方案I中碳酸钙纯度计算公式为________________________。
(2)方案II中高温锻烧样品应在 (填写仪器名称)中进行;为保证实验的准确性,整个实验过程中至少要称量 次。
(3)方案Ⅲ中不需要的数据是 (填选项编号)。
A.c3、V3 B.c1、Vl C.m2 D.m
(4)方案Ⅲ中为了减少实验误差,必要的操作是_____ (填选项编号)。
A.精确测定Na2CO3体积V3mL
B.精确配制Na2CO3溶液浓度c3mol/L
C.将步骤⑧所得沉淀洗涤,洗液并入④中
(5)方案IV:称取碳酸钙样品mg,按下图装置进行实验,根据实验原理,在图中方框内补充必要的仪器,并注明所用试剂名称。
27.(14分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
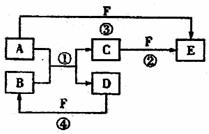
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是 。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则A、D反应产物的电子式是 反应③的化学方程式是 。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,B的结构
是 ,反应④的化学方程式是 。
26.(14分)(1)在20L恒容的密闭容器中,加入3molSO3(g)和1molO2(g),在一定温度下使其反应,反应至4min时,O2的浓度为0.008mol/L,当反应进行到8min,反应达到平衡,此时SO3的浓度c(SO3)=a mol/L。
①0min-4min内生成O2的平均速率为v(O2)= mol·L-1·min-1。
②达到平衡时,c(O2)=c(SO2),则a= 。在下图(左图)坐标系中作出
0min-8min及之后O2、SO3浓度随时间变化的曲线。
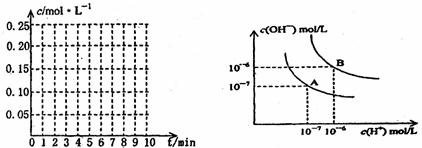
(2)水的电离平衡曲线如上图(右图)所示:
①若以A点表示25℃时水的电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。造成水的离子积增大的原因是 。
②100℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=7,则NaOH溶液和硫酸溶液的体积比为 ,此溶液中各种离子浓度由大到小排列的顺序是 。
13.下列叙述中不正确的是 ( )
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是发生了如下反应:
CH3COO-+H2O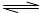 CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
B.在0.1mol/L Na2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO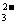 )+c(HCO
)+c(HCO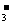 )
)
C.在0.1mol/L NH4Cl溶液中:c(H+)+c(NH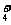 )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
D.将0.2mol/L的盐酸与0.1mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到的顺序为:c(OH-)<c(H+)<c(Al3+)<c(Na+)<c(Cl-)
第II卷(非选择题 共174分)
12.已知可逆反应:aA(g)+bB(g)
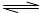 cC(g),物质的质量分数A%和C%随温度的变化曲线如图所示,下列说法正确的是 ( )
cC(g),物质的质量分数A%和C%随温度的变化曲线如图所示,下列说法正确的是 ( )
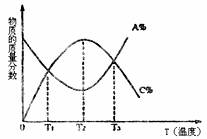
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡向正反应方向移动
11.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量B跟氯气反应除生成C外,另一产物是盐酸盐。
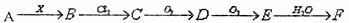
下列说法不正确的是 ( )
A.当X是强酸时,ABCDEF均含有同一种元素,F是硫酸
B.当X是强碱时,ABCDEF均含有同一种元素,F是硝酸
C.B和Cl2的反应一定是氧化还原反应
D.当X是强酸时,C常温下是气态单质
10.关于下图所示各装置的叙述中,正确的是 ( )
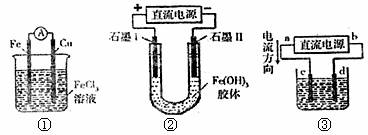
A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B.装置①中,铁做负极,电极反应式为:Fe3++e-=Fe2+
C.装置②通电一段时间后石墨II电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
9.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,
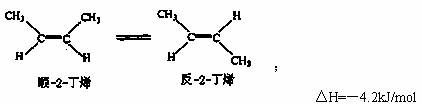
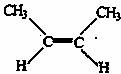 (g)+H2O→CH3CH2CH2CH3(g);
△H=-118.9kJ/mol
(g)+H2O→CH3CH2CH2CH3(g);
△H=-118.9kJ/mol
下列说法正确的是 ( )
A.顺-2-丁烯比反-2-丁烯稳定
B.加压和降温有利于平衡向生成顺-2-丁烯反应方向移动
C.顺-2-丁烯的燃烧热比反-2-丁烯小
D.反-2-丁烯氢化的热化学方程式为 △H=-114.7kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com