
17.(6分) (1) <(2分) = (2分);(2)< (2分)
22.(8分)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取
⑴写出SO2与酸性高锰酸钾溶液反应的离子方程式
。
⑵样品中FeS2的质量分数是(假设杂质不参加反应) 。
⑶煅烧
能制得98%硫酸_________kg。
长郡中学2009届高三第四次月考化学试卷答案
题号
1
2
3
4
5
6
7
8
答案
B
C
B
D
D
D
B
A
题号
9
10
11
12
13
14
15
16
答案
B
C
C
C
A
D
A
B
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是
。
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol?L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为 mol,则Ag与浓硝酸反应过程中生成的NO2体积为 mL。
(2)测定NO的体积
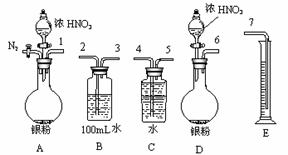
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是 (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置 (“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
 (1)测定硝酸的物质的量
(1)测定硝酸的物质的量
21.(14分)某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
20.(12分)X、Y、Z、W四种元素的原子序数依次增大,且均为短周期元素。X原子最外层电子数是次外层电子数的2倍;Y有两种常见的同素异形体,其中一种是很好的脱色剂和消毒剂。Z、W原子最外层电子数之和是X原子最外层电子数的2倍,这四种元素的原子电子层数之和为10。请填空:
(1)X与Y组成一种有特殊臭味的气体,已知该气体与氧气按物质的量之比为1:2混合后恰好完全燃烧,生成稳定的氧化物,在同温同压下测得燃烧前后气体的总体积不变,该反应的化学方程式为 。
(2)若W的单质是有毒气体,则它与强碱溶液反应的离子方程式为
;
由Z和Y可构成具有漂白作用的化合物,其电子式为 。
(3)若W的单质为黄色固体,且W与X可形成化合物XW2。
①XW2为 结构式为 ;
②Z的单质在XY2气体中燃烧的现象为 。
(4)若W的一种单质分子为正四面体结构,可用于制造燃烧弹和烟幕弹等。实验室里少量该单质应保存在 中。
19.(12分)现有浓度均为0.1 mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④碳酸钠,请回答下列问题:
⑴四种溶液中由水电离出的OH―浓度由大到小的顺序是(填序号)
。
⑵四种溶液中pH由小到大的顺序是(填序号) 。
⑶将②和③等体积混合后,混合液中各离子浓度由大到小的顺序是
。
⑷已知t℃,KW=1×10-13,在t℃时pH=11的NaOH溶液50mL与 mL与该温度下pH=1的盐酸溶液反应后,溶液恰好呈中性。
⑶若反应中生成0.2 mol HNO3,转移的电子数目为 个。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com