
25.(8分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物未列出)。
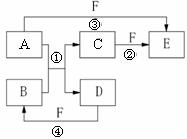
(1)若A是常见金属单质,与B的水溶液反应生成C和D。D、F是气体单质,D在F中燃烧时发出苍白色火焰。则反应②(在水溶液中进行)的离子方程式为 。
(2)若A、D为短周期元素组成的固体单质,一种为金属,另一种为非金属。且③④两个反应都有红棕色气体生成,则反应④的化学方程式为 。
(3)若B是由地壳中含量最高的两种元素组成,A的一种同素异形体与B、D属同一种类型的晶体,则反应①的化学方程式是 ,B与烧碱溶液反应的化学方程式是 。
24.(15分)A、B、C、D、E五种元素,已知:
(a)A原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同。E原子M层上的电子比K层多5个。
(b)常温下B2是气体,它对氢气的相对密度是16。
(c)C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
(d)D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激味的气体DB2。D在DB2中的含量为50%。
根据以上情况回答:
(1)A是 、C是 、D是 (写元素名称);
(2)E的原子结构示意图 ;F的电子式 ;E2的电子式 。
(3)F和AB2反应的化学方程式
(4)E2与水反应的离子方程式
(5)室温下,将2g苯和过量的B2混合,完全燃烧,放出83.6kJ的热量,写出表示苯
。
23.(12分)甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:
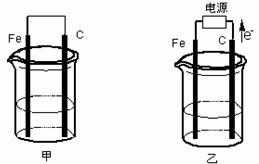
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的 棒;乙池中的 棒。
②在乙池中阳极的电极反应式是 。
(2)若两池中均盛放饱和NaCl溶液。
①写出甲池中正极的电极反应式 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。该反应的化学方程式为 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则此时溶液的pH= 。(不考虑电解产物的相互反应)
22.甲醇属于再生能源,可代替汽油作为汽车燃料。下列能正确表示甲醇燃烧热的热化学方程式为 ( )
A.CH3OH(1)+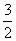 O2(g)=CO2(g)+2H2O(1) △H=+763.3kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H=+763.3kJ·mol-1
B.CH3OH(1)+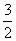 O2(g)=CO2(g)+2H2O(1) △H=-763.3kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H=-763.3kJ·mol-1
C.CH3OH(1)+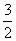 O2(g)=CO2(g)+2H2O(1) △H=-675.3kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H=-675.3kJ·mol-1
D.2CH3OH(1)+3 O2(g)=2CO2(g)+4H2O(1) △H=-1526.6kJ·mol-1
第Ⅱ卷(非选择题 共45分)
21.用含少量铁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是 ( )
①加盐酸溶解; ②加烧碱溶液溶解;③过滤;
④通入过量CO2生成Al(OH)3沉淀;
⑤加入盐酸生成Al(OH)3沉淀; ⑥加入过量烧碱溶液。
A.①⑥⑤③ B.②③⑤③ C.②③④③ D.①③⑤③
20.向某二价金属M的M(OH)2的溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体。如要计算金属M的相对原子质量,你认为还必需提供下列哪项数据 ( )
A.M(OH)2溶液的物质的量浓度 B.与MCO3反应的盐酸的物质的量浓度
C.MCO3的质量 D.题给条件充足,不需要在补充数据
19.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备--2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备--2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是 ( )
A.高铁酸钾与水反应时,水发生还原反应
B.湿法中每生成1molNa2FeO4共转移3mol电子
C.干法中每生成1molNa2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降
18.对于某些离子的检验及结论一定正确的是 ( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,原溶液一定有NH4
D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,原溶液一定有Ba2+
17.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是 ( )
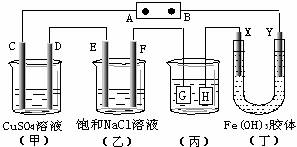
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1∶2∶2∶2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液选是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带正电荷
16.分析下图所示各物质能量变化关系,下列热化学方程式正确的是 ( )
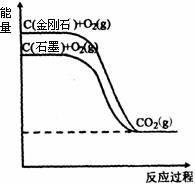
A.C(金刚石)+O2(g)=CO2(g); ΔH1=a kJ/mol(a<0)
B.C(石墨)+O2(g)=CO2(g); ΔH2=b kJ/mol(b>0)
C.C+O2=CO2(g); ΔH3=c kJ/mol(c<0)
D.C(金刚石)=C(石墨); ΔH4=d kJ/mol(d>0)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com