
1.2009年10月16日至28日,第十一届全运会将在济南隆重举行。下列有关全运会的宣传报道中明显失实的是
A.全运会开幕前将部分燃柴油的公交车改造为燃天然气,突出了“绿色全运”
B.全运会火炬“如意”采用丙烷为燃料,丙烷的一氯代物有二种
C.游泳馆采用ETFE[聚氟乙烯(C2H2F2)]塑料膜作为建筑体系的材料,它属于天然高分子材料
D.全运会场馆采用新研制涂料氮化镓,体现了“科技全运”理念
2009.7
第Ⅰ卷(选择题,共40分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg24 Ca40 Fe 56
选择题(本题包括16小题。1-8每题2分。9-16题每题3分,共40分,每小题只有一个选项符合题意)
29.(17分) 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,以下是过氧化氢法生产亚氯酸钠的工艺流程图:
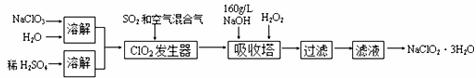
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O.
②ClO2的沸点为283K,纯ClO2易分解爆炸.
③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸.
(1)ClO2发生器中所发生反应的离子方程式为_____________________________,当反应中有1mol电子发生转移时,所得还原产物的质量为 .发生器中鼓入空气的作用可能是_______________(选填序号).
A.将SO2氧化成SO3,增强酸性
B.稀释ClO2以防止爆炸
C.将NaClO3氧化成ClO2
(2)160 g/LNaOH溶液的物质的量浓度为_______________.若要计算该溶液的质量分数,还需要的一个数据是_______________.
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是__________________________________________.
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是______________________(填操作名称).若要从滤液中得到较高纯度NaClO2·3H2O晶体还必须进行的操作是___________(填操作名称).
(5)经检测该粗晶体中含有少量NaCl,其原因是 ,则在吸收塔中,可代替H2O2加入的试剂是____________(填序号)
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
28.(10分) 已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+) > c(CH3COO-) > c(OH-) > c(H+)
②c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
③c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
④c(Na+) > c(OH-) > c(CH3COO-) > c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填编号).在该溶液中:c(Na+) – c(CH3COO -) = ____________.
(2)若上述关系中③是正确的,则溶液中的溶质为 .
(3)上述关系中不可能成立的是 (填编号),你判断的理由是____________
_____________________________________________________________________
27.(19分) 下图表示某淡黄色固体A与其他化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料.
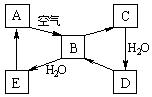
(1)B分子是极性分子,其分子的空间构型是_______________,C分子是非极性分子,其分子的空间构型是____________.
(2)写出E与A的氢化物反应生成A的化学方程式:
;
(3)写出一个由D生成B的反应的化学方程式:
;
(4)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的KOH溶液混合.
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是(用离子方程式解释)______________________________________________________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是:
,若蒸干该溶液最终所得残余物是 (填化学式).
26.(14分) 在一定温度和催化剂下,将4 mol H2和1 mol N2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8 mol NH3.
(1)在2min内以N2表示的反应速率为 ;此时H2的转化率为___________.
(2)从反应开始到2min末,反应共释放了Q kJ的热量,则该反应的热化学方程式为
___________________________________________________________________.
(3)若保持温度和压强不变,充入少量稀有气体,则NH3的物质的量________(填“增大”、“减小”、“不变”).
(4)若上述反应在维持与题干相同条件下从逆反应开始进行,开始时加入0.4 mol N2,若要使平衡时各物质的质量分数与原来平衡完全相同,则还应该加入H2和NH3的物质的量分别为n(H2) = _______________mol,n(NH3) = _______________mol.
13.某温度下,在容积固定不变的密闭容器中发生可逆反应:X(g) + 2Y(g) 2Z(g),平衡时,X、Y、Z的物质的量分别为1mol、1mol、2mol,保持温度不变,再向容器中分别充入1mol、1mol、2mol的X、Y、Z。下列叙述正确的是( )
2Z(g),平衡时,X、Y、Z的物质的量分别为1mol、1mol、2mol,保持温度不变,再向容器中分别充入1mol、1mol、2mol的X、Y、Z。下列叙述正确的是( )
A.刚充入时,反应速率v(正)减小,v(逆)增大
B.当容器内气体密度不变时达到新平衡
C.达到新平衡时,容器内气体的压强小于原平衡的两倍
D.达到新平衡时,容器内气体X的物质的量分数是原平衡的两倍
第Ⅱ卷 非选择题
12.常温时,将下列溶液等体积混合后,所得混合溶液的pH小于7的是( )
A.pH为2的醋酸溶液与pH为12的氢氧化钠溶液
B.0.0l mol·L-1 的醋酸溶液与0.01 mol·L-1的氢氧化钠溶液
C.pH为2的硫酸溶液与pH为12的氢氧化钠溶液
D.0.010 mol·L-1的盐酸溶液与0.010 mol·L-1的氢氧化钡溶液
11.短周期元素X、Y能形成化合物XY.下列有关说法错误的是( )
A.若化合物XY含有共价键,则X、Y可能同周期
B.若化合物XY为强电解质,则X、Y可能同主族
C.若X、Y同主族,则化合物XY可能为原子晶体
D.若化合物XY为极性分子,则该分子中原子最外层均达到8电子稳定结构
10.某无色混合气体依次通过浓硫酸和Na2O2,若气体体积不断减少,最后颜色变深,则原混合气体的成份可能是( )
A.H2、Cl2、H2S B.NH3、NO、CO2
C.NH3、O2、NO D.HCl、NO2、CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com