
17.(10分)工业上生产硫酸时,利用催化氢化反应将SO2转化为SO3是一个关键步骤。
(1)SO2转化为SO3是在接触室(如下图)里进行的,中部是一个热交换器,它是由导热性能良好的管状材料(如铜管)制成。温度低的气体A从管外流过,上层催化剂反应后的热气体从管内流过,通过导热材料进行气体与气体的热交换。实验室里有很多实验也需要进行热交换(除直接加热外),如在进行气体和气体热交换时,通常使用玻璃导管,气体和液体热交换时,通常使用 (填仪器名称),请你举一例有液体与流体热交换的化学实验 (填实验名称)。
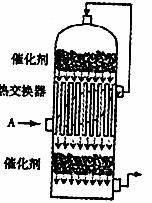
(2)某温度下,2SO2(g)+O2(g)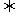 2SO3(g) △H=-196kJ·mol-1。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ。此时二氧化硫的转化率为 ,该温度下平衡常数K=
;
2SO3(g) △H=-196kJ·mol-1。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ。此时二氧化硫的转化率为 ,该温度下平衡常数K=
;
(3)一定温度下,向体积为1L的密闭容器中充入2molSO3(g)和1molO2(g),发生下列反应:2SO2(g)+O2(g)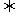 2SO3(g),达到平衡时SO2的体积分数为a。若保持温度不变,以下列量作为起始量发生反应,达到平衡后SO2体积分数仍为a的是
2SO3(g),达到平衡时SO2的体积分数为a。若保持温度不变,以下列量作为起始量发生反应,达到平衡后SO2体积分数仍为a的是
(填字母)。
A.向体积为1L的容器中充入2molSO3
B.向体积为1L的容器中充入4molSO2和2molO2
C.向体积为1L的容器中充入1.8molSO2、0.9molO2、0.2molSO3
D.向体积为0.5L的容器中充入1molSO2、0.5molO2
E.向体积为0.5L的容器中充入2molSO2和1molO2
(4)某学生想以下图所示装置的电化学原理生产硫酸,写出通入O2一极的电极反应式 。
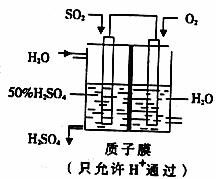
(5)若通入SO2的速率为2.24L·min-1(标准状况),为稳定持续生产,硫酸溶液的质量 分数应维持50%,则左侧水的流入速率应为 mL·min-1。
16.(10分)氯化亚铜在氯的衍生物产品中占有较突出的位置,在有机合成工业中可作催化剂。以下是从含Cu2+、Fe3+的电镀废水中制备氯化亚铜的工艺流程图。
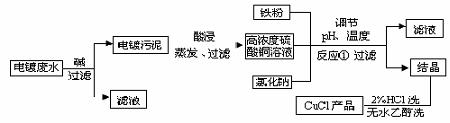
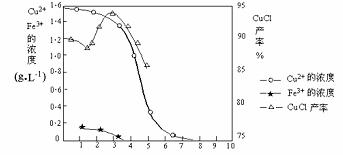
用滤液中Cu2+、Fe3+的含量对pH作图,可直观地反映出滤液中金属离子含量与pH之间的关系以及反应①系统pH与CuCl产率的关系。
请回答以下问题:
(1)含Cu2+、Fe3+的电镀废水加碱沉淀时,会有Fe(OH)3生成。当pH=5时,在电镀废水中再加入氢氧化钠溶液生成电镀污泥的主要成分为_____________。
(2)由反应①制备CuCl时的最佳pH在________________左右。
(3)对CuCl产率探究时发现反应①在隔绝空气条件下进行时CuCl产率较高,由此推测CuCl具有______________性。
(4)反应①中1mol铁粉完全反应转移2mol电子,写出其离子反应方程式为_________。如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,请完成这一反应的化学方程式____________________。
15.(10分)下图是工业生产硝酸的流程。
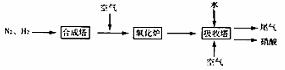
合成塔中内置铁触媒,氧化炉中内置Pt – Rh合金。请回答下列问题:
(1)1909年化学家哈伯在实验室首次合成了氨。2007年格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:
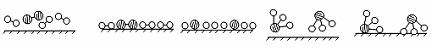
图① 图② 图③ 图④ 图⑤
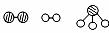 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为
,
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为
,
。
(2)已知N≡N的键能是946kJ·mol-1,H-H的键能为436kJ·mol-1,N-H的键能为393kJ·mol-1,写出合成塔中发生反应的热化学方程式 。
(3)已知4NH3(g)+3O2(g)====2N2(g)+6H2O(g) △H=-1266.8kJ·mol-1;
4NH3(g)+5O2(g)====4NO(g)+6H2O(g) △H=-905.8kJ·mol-1;
则热化学方程式N2(g)+O2(g)===2NO(g) △H= kJ·mol-1。
(4)吸收塔中通入空气的目的是 。
14.(12分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂,常温下二氧化氯为黄绿色或橘黄色气体,易溶于水,易与碱液反应,其性质非常不稳定,温度过高、二氧化氯的水溶液质量分数高于30%等均有可能引起爆炸。某研究小组设计下图所示实验装置制备ClO2。
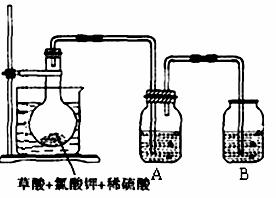
现称取12.25gKClO3和9g草酸(H2C2O4)放入烧瓶中,然后再加入足量的稀硫酸,水浴加热。
回答下列问题:
(1)已知反应后的产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为 。
(2)在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60℃~
80℃之间。这样操作的目的是 ,
图示装置中缺少的一种必须的玻璃仪器是 。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放 (填序号)。
a. 50mL 60℃的温水 b. 50mL冰水 c. 50mL饱和食盐水 d. 50mL NaOH溶液
(4)本实验所制得的二氧化氯水溶液质量分数约为 。(小数点后保留两位)
(5)二氧化氯可迅速氧化硫化物,以除去有机硫产生的臭味,改善水产养殖水体的水质。取适量二氧化氯溶液加入到硫化氢溶液中,再向其中加入少量氯化钡溶液,发现有白色沉淀生成。硫化氢溶液与二氧化氯发生反应的离子方程式为 。
13.(3分)下列有关实验及安全知识的叙述,正确的是 (填序号)。
A.苯酚不慎沾在手上,可用NaOH溶液洗去
B.蒸馏时应使温度计水银球靠近蒸馏烧瓶支管口
C.用蒸发结晶法可除去NaCl中混有的少量KNO3
D.可用萃取分液的方法提取碘水中的碘单质
E.实验室一般用稀硫酸和大理石制取CO2
F.往某溶液中滴加CaCl2溶液产生白色沉淀,则证明该溶液中一定含有CO2-3
12.下列溶液中有关物质的量浓度关系正确的是 ( )
A.0.2mol·L-1的NaHCO3溶液:c(HCO-3)>c(CO2-3)>0.1mol·L-1>c(H2CO3)
B.pH=2的HCl溶液与pH=12的氨水等体积混合:c(Cl-)>c(NH+4)>c(H+)>c(OH-)
C.0.2mol·L-1CH3COOH溶液和0.2mol·L-1CH3COONa溶液等体积混合:
c(CH3COO-)+c(OH-)-c(H+)=0.1mol·L-1
D.0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合:
c(CO2-3)+2c(OH-)=c(HCO-3)+3c(H2CO3)+2c(H+)
非选择题(共78分)
11.在某体积固定的密闭容器中进行如下可逆反应:A(g)+B(g) 2C(g),在反应过程中体系的温度持续升高,实验测得混合气体中的C的含量与温度关系如图所示。下列说法正确的是 ( )
2C(g),在反应过程中体系的温度持续升高,实验测得混合气体中的C的含量与温度关系如图所示。下列说法正确的是 ( )
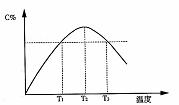
A.此反应的正反应是吸热反应
B.反应在T2温度时达到平衡
C.T2温度时正反应速率大于逆反应速率
D.T2温度时正反应速率大于T1温度时正反应速率
10.普通水泥在固化过程中自由水分子减少并产生Ca(OH)2溶液呈碱性。根据这一特点,科学家发明了电动势(E)法测水泥初凝时间,此法的原理如图所示,反应的总方程为:
2Cu+Ag2O=Cu2O+2Ag。下列有关说法不正确的是 ( )
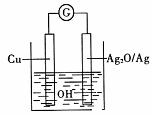
A.工业上制备普通水泥的主要原料是黏土和石灰石
B.测量原理装置图中Ag2O/Ag极发生氧化反应
C.负极的电极反应式为:2Cu+2OH-2e-=Cu2O+H2O
D.在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化
9.“甲型H1N1”流感疫情已构成“具有国际影响的公共卫生紧急事态”。已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示。下列说法正确的是 ( )
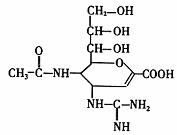
A.该物质的分子式为C12H19N4O7
B.1mol该物质的NaOH溶液反应,可以消耗4molNaOH
C.在一定条件下,该物质可以发生消去、加成、取代等反应
D.该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应
8.下列反应的离子方程式正确的是 ( )
A.用Na2CO3溶液作洗涤剂:CO-23+H2O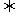 HCO-3+OH-
HCO-3+OH-
B.用氯气给自来水消毒:Cl2+H2O=2H++Cl-+ClO-
C.电解饱和食盐水制烧碱:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+=2Fe3++3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com