
2.下列反应不是氧化还原反应的是
A.Fe+H2SO4(稀)=FeSO4+H2↑
B.H2+CuO Cu+H2O
Cu+H2O
C.3NO2+H2O=2HNO3+NO
D.Ca(HCO3)
2 CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑
1.下列物质中碱性最弱的是
A.氢氧化钠 B.氢氧化镁 C.氢氧化铝
D.氢氧化钙
B.氢氧化镁 C.氢氧化铝
D.氢氧化钙
24.针对以下A-F六个反应,填写空白:
A.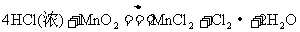
B.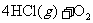

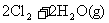
C.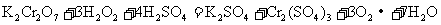
D.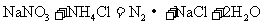
E.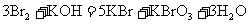
F.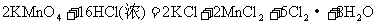
(1)反应C中氧化剂是___________,其中发生变价的元素是___________,该元素在反应物里的化合价是___________。
(2)在以上反应中,单质既是氧化产物又是还原产物的反应是(填代号)________。单质既作氧化剂又作还原剂的反应是(填代号)___________,该反应中,氧化剂和还原剂的分子个数比为___________。
(3)反应A、B、F中,三种氧化剂强弱顺序为______________________。
22.4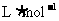 是标准状况下的气体摩尔体积。在不同的温度和压强下,气体摩尔体积的数值也会发生变化。例如,中273℃、101kPa条件下,Vm约为44.8
是标准状况下的气体摩尔体积。在不同的温度和压强下,气体摩尔体积的数值也会发生变化。例如,中273℃、101kPa条件下,Vm约为44.8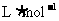 。①请判断101kPa、50℃时的Vm比22.4
。①请判断101kPa、50℃时的Vm比22.4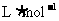 ___________(填“大”或“小”)。②标准状况下,67.2L气体的物质的量为___________mol。
___________(填“大”或“小”)。②标准状况下,67.2L气体的物质的量为___________mol。
③已知KClO3在MnO2催化、101kPa、210℃时即可分解得到O2(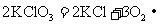 );现将122.5g KClO3在MnO2催化、101kPa条件下加热至273℃。若完全分解,则可以得到标准状况下的O2___________L。
);现将122.5g KClO3在MnO2催化、101kPa条件下加热至273℃。若完全分解,则可以得到标准状况下的O2___________L。
(2)反应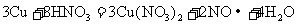 的离子方程式为:________
_______________________。每生成11.2L标准状况下的气体,转移电子的物质的量为___________mol。
的离子方程式为:________
_______________________。每生成11.2L标准状况下的气体,转移电子的物质的量为___________mol。
23.(1)气体摩尔体积是指在一定温度和压强下,单位物质的量的气体所占的体积。
22.有5瓶白色固体试剂,分别是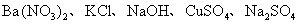 ,现只提供蒸馏水,通过下面的实验步骤可鉴别它们。请填写下列空白:
,现只提供蒸馏水,通过下面的实验步骤可鉴别它们。请填写下列空白:
(1)各取适量固体试剂分别加入5支试管中,加入适量蒸馏水,振荡试管,观察到的现象是_________________________。被检出的物质的化学式(分子式)是_________。
(2)分别取未检出液,往其中加入上述已捡出的溶液。观察到的现象和相应的离子方程式:①现象:试管中有白色沉淀生成,离子方程式为:______________________;②现象;试管中有蓝色沉淀生成,离子方程式为:______________________。
(3)最后可利用试剂___________(填化学式)鉴别余下未检验出的物质。
21.某气体,它由三原子分子构成。该气体内体积为VL(标准状况下),它的摩尔质量为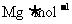 ,若阿伏伽德罗常数用NA表示,则:
,若阿伏伽德罗常数用NA表示,则:
(1)该气体的物质的量为___________mol。
(2)该气体的质量为___________g。
(3)该气体所含原子总数为___________个。
(4)该气体中标准状况下的密度为___________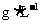 。
。
(5)该气体溶于水后形成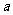 L溶液(该气体不和水反应),其溶液的物质的量浓度为___________
L溶液(该气体不和水反应),其溶液的物质的量浓度为___________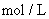 。
。
20.为除去粗盐中的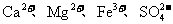 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
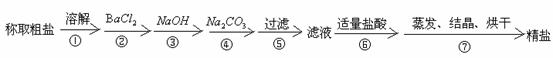
(1)判断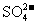 已除尽的方法是______________________。
已除尽的方法是______________________。
(2)操作②为什么不用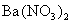 溶液?其理由是______________________。
溶液?其理由是______________________。
(3)第④步中,相关的离子方程式是_________________________________。第⑥步中,相关的离子方程式是_________________________________。
(4)实验室进行⑦步NaCl溶液蒸发时,一般有以下操作过程①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为_________________________________。
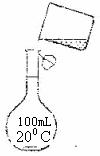
(5)为检验精盐纯度,需配制250mL 0.2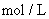 NaCl(精盐)溶液,如下图是该同学转移溶液的示意图,图中的错误是_________________________________。
NaCl(精盐)溶液,如下图是该同学转移溶液的示意图,图中的错误是_________________________________。
(6)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A、称量NaCl时已潮解 ( )
B、天平的砝码已锈蚀 ( )
C、定容摇匀时,液面下降又加水 ( )
D、定容时俯视刻度线 ( )
19.下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
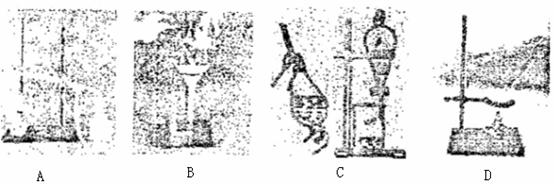
请根据混合物分离或提纯的原理,回答下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去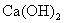 溶液中悬浮的CaCO3___________;
溶液中悬浮的CaCO3___________;
(2)从碘水中提取碘___________;
(3)分离植物油和水___________;
(4)与海求晒盐原理相符的是___________;
(5)分离乙醇和氧化钠溶液___________。
18.已知浓H2SO4和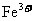 都可以将Cu氧化成
都可以将Cu氧化成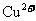 ,浓H2SO4也可以将
,浓H2SO4也可以将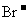 氧化成Br2,Fe与Br2反应生成FeBr3。由此可以确定上述有关物质氧化性由强到弱的顺序为
氧化成Br2,Fe与Br2反应生成FeBr3。由此可以确定上述有关物质氧化性由强到弱的顺序为
A.浓H2SO4>Br2>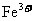 >
>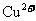 B.浓H2SO4>
B.浓H2SO4>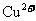 >
>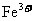 > Br2
> Br2
C.Br2>浓H2SO4>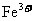 >
>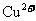 D.
D.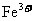 >
>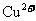 > Br2>浓H2SO4
> Br2>浓H2SO4
第Ⅱ卷(非选择题 共46分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com