
28.(6分)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖。其晶胞结构如图。
(1)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式:
27.(16分)现有部分短周期元素的性质或原子结构如下表:
元素编号
元素性质或原子结构
T
M层上有2对成对电子
X
最外层电子数是次外层电子数的2倍
Y
常温下单质为双原子分子,其氢化物水溶液呈碱性
Z
元素最高正价是+7价
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是 。
(2)元素Y与氢元素形成一种离子YH4+ ,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是_____。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
非金属性强弱的判断方法有很多种,请写出另一种判断方法(用化学方程式表示):
_____________________________________________________________
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是_______________ _____ ___ 。
26.(18分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
b
h
j
a
c
f
i
l
m
e
g
d
k
(1)上述元素的单质可能是电的良导体的是______(填字母代号)。
(2)下表是一些气态基态原子的第一、二、三、四级电离能(kJ?mol-1):
锂
X
Y
第一电离能
519
502
580
第二电离能
7296
4570
1820
第三电离能
11799
6920
2750
第四电离能
9550
11600
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______________________________。
②表中Y可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的电子式是 ________和_________ 。
(3)写出元素e的电子排布式____________________。
(4)以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
(5)根据元素原子的外围电子排布的特征,可将元素周期表分成几个区域,其中,元素c、m分别位于________区、__________区
25.(10分)在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和族序数(A)有如下经验公式:K=A/n (K为A与n的比值)。请选编号回答下列问题:
A.两性金属 B.金属 C.非金属 D.稀有气体
(1)当n一定时,K值越大,则元素的_____________性越强。
(2)当A一定时,K值越小,则元素的________性越强。
(3)当K=0,则该元素系_________元素;
当K=l时,则该元素系_________元素(n≠1);
当K<1时,则该元素系_________元素。
24.(16分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,D的最高正价与最低负价的代数和为4,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________, D是________,E是_________。
(2)写出B元素原子的轨道表示式______________________________________。
(3)写出C元素原子的电子排布式_________________________。
(4)E与B、D所形成的化合物的微粒间作用力是____________。
(5)写出A和B形成的化合物的电子式______________________
A____________;B____________;C____________;D____________。
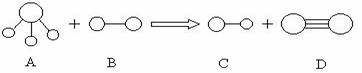
23.(8分)组成A、B、C、D分子的元素原子序数均小于10,它们之间能发生如下图所示的反应。其中A的水溶液能使酚酞试夜变红,组成B的元素的电负性在周期表中最大。请写出A、B、C、D的化学式:
22.(10分)用“>”、“<”、“=”填空
(1)第一电离能:P_________S;
(2)酸性:H3PO4 _______ H2SO4;
(3)稳定性:H2O______H2S_______H2Se;
(4)微粒半径:S2-____Cl―______K+;S____S2-
(5)碱性:KOH_________NaOH________Al(OH)3;
(6)元素的电负性:S_____Cl。
21.(6分)试用电子式表示下列过程
(1)MgCl2 :________________________________________________________________
(2)Br2: ________________________________________________________________
(3)H2O: ________________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com