
 (6)现有A和苯酚的混合物,它们的物质的量之和为 n mol。该混合物完全燃烧生成a L CO2和b g H2O(气体体积为标准状况下的体积)。设混合物中A的物质的量为x mol,列出x 的计算式
。
(6)现有A和苯酚的混合物,它们的物质的量之和为 n mol。该混合物完全燃烧生成a L CO2和b g H2O(气体体积为标准状况下的体积)。设混合物中A的物质的量为x mol,列出x 的计算式
。
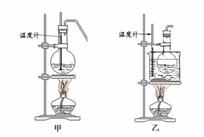
(5)甲、乙两装置均可用作实验室由C制取B的装置,乙图采用甘油浴加热(甘油沸点
甲、乙两装置比较,乙装置有哪些优点 。
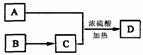
(4)如A可以发生如图所示转化关系 ,D的分子式为C10H12O3 ,
A与C反应的化学方程式 。
24.碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1:1,含氧元素的质量分数为31.58%。A遇FeCl3溶液显紫色,其苯环上的一氯取代物有两种,请回答下列问题:
(1)A的分子式是 。
(2)若A能与NaHCO3溶液反应, A的结构简式为 ;写出A 与NaHCO3溶液反应的化学方程式 。
(3)写出符合下列要求的A的同分异构体的结构简式(只写出三种即可)
①与A的取代基数目相同;②可以和浓溴水发生取代反应,1mol该同分异构体可与2mol Br2发生取代反应;③属于酯类物质。
、 ,
 N2(g)+3H2(g)
2NH3(g);△H=-92.4kJ/mol。达到平衡时,体积为反应前的三分之二。求:
N2(g)+3H2(g)
2NH3(g);△H=-92.4kJ/mol。达到平衡时,体积为反应前的三分之二。求:
?达到平衡时,N2的转化率为 。
?若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。
试比较反应放出的能量:(1) (2)(填“>”、“<”或“=”)。
?若将2mol N2和4mol H2放入起始体积相同的恒容容器中,在与I相同的温度下达到平衡。试比较平衡时NH3的浓度:I Ⅱ(填“>”、“<”或“=”)。
?常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应
;
②氨水中水电离出的c(OH―) 10―7mol/L(填写“>”、“<”或“=”);
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为 。
(3)氨是一种重要的化工原料,在一定条件下氨可与其他物质反应生成化肥──尿素〔 CO(NH2)2 〕。已知3.01×1022个尿素分子在高温、高压下分解生成
。
已知三个A分子可反应得到一分子三聚氰胺,请写出A的结构式 。
(4).在某压强恒定的密闭容器中加入2mol N2和4mol H2,发生如下反应:
23.现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到
请回答:
(1)哈伯合成氨的化学方程式为____________ ;在电解法合成氨的电解池中______(填“能”或“不能”)用水作电解质溶液的溶剂,原因是____________
。
(2)新法合成氨电解池中的电解质能传导H+,请写出阴极反应式______________ ______ 。
22.A、B、C、D是原子序数由小到大的四种短周期元素。已知C和D可形成化合物X,A和B可形成化合物Y,将少量X和过量Y一起放入水中,可放出一种无色无嗅的气体单质,同时得到一种无色澄清的溶液。向此溶液中滴加过量X的水溶液时,可生成一种白色胶状沉淀物Z(Z与Y的相对分子质量相等),过滤后得到一种无色澄清溶液,其中含G,G在焰色反应中火焰呈黄色,向G的水溶液中加入酸化的硝酸银溶液时,能生成一种白色沉淀物,根据以上推断,请完成下列填空:
(1)X的化学式是 ,Y的电子式是 。
(2)4molX与6molY在水溶液中发生反应的化学方程式为
。
(3)生成白色胶状沉淀物Z的离子方程式为
。
将体积比为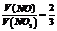 的混合气体通入足量的氢氧化钠溶液中,气体完全反应后,所得溶液中
的混合气体通入足量的氢氧化钠溶液中,气体完全反应后,所得溶液中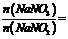 。
。
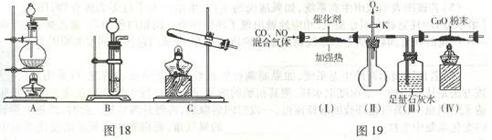
① 实验前关闭旋塞K,先通氮气排净装置中的空气,其目的是
② 装置(Ⅲ)的主要作用 ,
③ 加热停止后,打开旋塞K,放人适量氧气时,装置(Ⅱ)中可观察到的现象是
。
④ 该套装置中有不完善之处,还应在装置(Ⅳ)后补充 。
(4) 工业上通常用氢氧化钠溶液吸收一氧化氮、二氧化氮的混合气体。相关反应为
2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2Na0H=2NaNO2+H2O。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com