
3.弱酸的酸式阴离子在酸性较强或碱性较强的溶液中均不能大量共存.它们遇强酸(H+)会生成弱酸分子;遇强碱(OH-)生成正盐和水. 如:HSO3-、HCO3-、HS-、H2PO4-、HPO42-等
2.弱酸阴离子只存在于碱性溶液中。如CH3COO-、F-、CO32-、SO32-、S2-、PO43-、 AlO2-均与H+不能大量共存.
离子在溶液中能否大量共存,涉及到离子的性质及溶液酸碱性等综合知识。凡能使溶液中因反应发生使有关离子浓度显著改变的均不能大量共存。如生成难溶、难电离、气体物质或能转变成其它种类的离子(包括氧化一还原反应).
一般可从以下几方面考虑
1.弱碱阳离子只存在于酸性较强的溶液中.如Fe3+、Al3+、Zn2+、Cu2+、NH4+、Ag+ 等均与OH-不能大量共存.
3.溶液酸碱性.
2S2- +SO32-+6H+=3S↓+3H2O
5Cl-+ClO3-+6H+=3Cl2↑+3H2O
S2-、SO32-,Cl-、ClO3-在酸性条件下均反应而在碱性条件下共存.
Fe2+与NO3-共存,但当酸化后即可反应.3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
一般含氧酸盐作氧化剂时,在酸性条件下,氧化性比在中性及碱性环境中强.故酸性KMnO4溶液氧化性较强.
1. 浓度:可能导致反应能否进行或
产物不同

|
反应类型 |
实 例 |
|
同一物质不同 元素的原子间 |
光 4HNO3 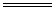 4NO2↑+O2↑+2H2O 4NO2↑+O2↑+2H2O 或 热 光 2HClO 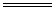 2HCl+O2↑ 2HCl+O2↑ 加 热 2KMnO4 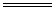 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑2AgNO3 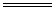 2Ag+2NO2↑+O2↑ 2Ag+2NO2↑+O2↑2KClO3  2KCl+3O2↑ 2KCl+3O2↑ |
|
同一物质同一元素 不同价态原子间 |
5NH4NO3=4N2↑+2HNO3+9H2O Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓ |
 同一物质同一元素 同一物质同一元素同一价态原子间 (歧化反应) |
Cl2+2NaOH=NaCl+NaClO+H2O 3NO2+H2O  2HNO3+NO 2HNO3+NO2Na2O2+2H2O 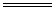 4NaOH+O2↑ 4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2↑ 2H2O2  2H2O+O2↑ 2H2O+O2↑CaO+3C(电炉) 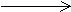 CaC2+CO↑ CaC2+CO↑ SiO2+3S SiC+2CO↑ 浓硫酸 H2C2O4  H2O+CO2↑+CO↑ H2O+CO2↑+CO↑ |
②在碱性介质中的反应,生成物中无H+;
③在近中性条件,反应物中只能出现H2O,而不能有H+或OH -,生成物方面可以 有H+或OH –
现把H+、OH -、H2O在不同条件下的相互关系列于下表:
|
条 件 |
反应物中余O |
反应物中缺O |
|
酸性溶液 |
O
+ 2H+ → H2O |
H2O
→ O + 2H+ |
|
近中性溶液 |
O
+ H2O → 2OH - |
H2O
→ O + 2H+ |
|
碱性溶液 |
O
+ H2O → 2OH - |
2OH
- → O + H2O |
|
氧化剂 |
还原剂 |
|
活泼非金属单质:X2、O2、S |
活泼金属单质:Na、Mg、Al、Zn、Fe 某些非金属单质: C、H2、S |
|
高价金属离子:Fe3+、Sn4+?? 不活泼金属离子:Cu2+、Ag+ 其它:[Ag(NH3)2]+、新制Cu(OH)2? |
低价金属离子:Fe2+、Sn2+??? 非金属的阴离子及其化合物: S2-、H2S、I -、HI、NH3、Cl-、HCl、Br-、HBr |
|
含氧化合物: NO2、N2O5、MnO2、Na2O2、H2O2?、HClO、 HNO3、浓H2SO4、NaClO、Ca(ClO)2、KClO3、 KMnO4、王水 |
低价含氧化合物: CO、SO2、H2SO3、Na2SO3、Na2S2O3、NaNO2、 H2C2O4、含-CHO的有机物: 醛、甲酸、甲酸盐、甲酸某酯、葡萄糖、麦芽糖等 |
既可作氧化剂又可作还原剂的有:
S、SO32-、HSO3-、H2SO3、SO2、NO2-、Fe2+等,及含-CHO的有机物
4.复分解反应
(1)本质:通过两种化合物相互接触,交换成份,使溶液中离子浓度降低.
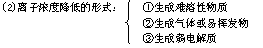
(3)基本类型:
①酸 + 碱 → 盐 + 水(中和反应)
②酸 + 盐 → 新酸 + 新盐
③碱 + 盐 → 新碱 + 新盐
④盐 + 盐 → 两种新盐
⑤碱性氧化物+酸 → 盐+水
思考题:
(1)酸与碱一定能发生反应吗?若能,一定是发生中和反应吗?
(2)复分解反应中的每一类反应物必须具备什么条件?
(3)盐与盐一定发生复分解反应吗?
(4)有盐和水生成的反应一定是中和反应吗?
提示:
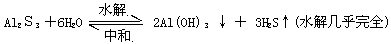 (1)酸与碱不一定能发生中和反应.联系中和反应的逆反应是盐的水解知识.如:
(1)酸与碱不一定能发生中和反应.联系中和反应的逆反应是盐的水解知识.如:
酸与碱发生的反应也不一定是中和反应.如:
2Fe(OH) 3 + 6HI = 2FeI2 + I2 + 6H2O
2Fe(OH)2 + 10HNO3(稀) = 3Fe(NO3)3 + NO↑+ 8H2O
故特别要注意氧化性酸(碱)与还原性碱(酸)很可能发生的是氧化-还原反应.
(2)复分解反应中反应物的条件:
①盐 + 盐、盐 + 碱的反应物一般要可溶且在溶液中进行或加热时进行.如
 ②盐1 + 酸1 → 盐2 + 酸2
②盐1 + 酸1 → 盐2 + 酸2
一般只需满足以下两条中的各一条:i)强酸制弱酸即酸性:酸1>酸2
ii)难挥发酸制易挥发酸,即挥发性:酸1<酸2
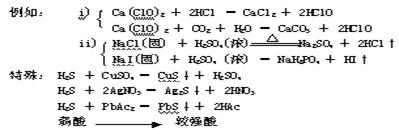
原因:上述三种金属硫化物溶解度特小,满足离子反应朝离子浓度降得更低的方向进行.
(3)盐与盐可能发生的反应有:
①复分解 ②双水解 ③氧化-还原 ④络合反应
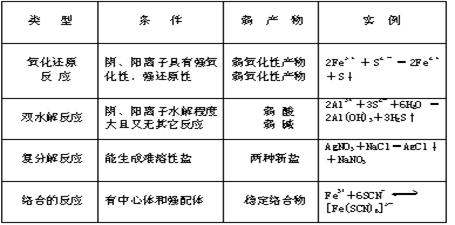 现列表比较如下:
现列表比较如下:
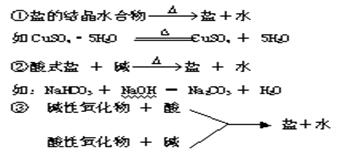
(4)生成盐和水的反应有:
3.置换反应
判断:有单质参与或生成的反应一定是置换反应吗?
结论:反应物或生成物各两种且其中一种必定是单质的反应才称作置换反应.
分类:可有多种分类方法,如根据两种单质是金属或非金属来分;也可根据反应物状态来分;还可以根据两单质的组成元素在周期表中的位置来分.
注意:下列置换反应特别值得重视.
①2Na + 2H2O = 2NaOH + H2↑
②3Fe +4H2O Fe3O4 + 4H2↑
Fe3O4 + 4H2↑
③F2 + 2H2O = 4HF + O2 ④Cl2 + H2S = S + 2HCl
⑤2H2S + O2 = 2S + 2H2O
⑥2C +SiO2  Si + 2CO
Si + 2CO
⑦2Mg +CO2 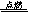 2MgO + C
⑧2Al +Fe2O3
2MgO + C
⑧2Al +Fe2O3 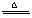 2Fe + Al2O3
2Fe + Al2O3
⑨C +H2O  CO + H2
⑩3Cl2 +2NH3
CO + H2
⑩3Cl2 +2NH3  N2 + 6HCl
N2 + 6HCl
⑾Si +4HF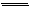 SiF4+ 2H2
SiF4+ 2H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com