
4. 计算反应热的规范书写:
(1)设未知量,写方程式,列比例式,求解,答。
(2)必须代数据,且数据后必须带单位。
(3)热化学方程式必须标明每种物质的聚集状态。
(4)注意正负号:放热反应的△H必然为负,但题目要求放出的热量时,放出的热量必须为正!
(5)△H为对应于某一特定反应的反应热,而不是某种物质的反应热,因此不能在△H后用下标或加括号代表某种物质的反应热!
(6)不能出现“3molC2H2的燃烧热”类似的表述!
(7)热化学方程式的加减用数字代表即可,不需要写出中间方程式。
[专题综合]
3. 混合物的计算 十字交叉法
极限分析法
平均值法
估算法
2. 多步反应的计算:运用盖斯定律将热化学方程式(包括△H)进行加或减,得到新的热化学方程式后,再列比例关系式。
 方程组法
方程组法
1. 单一反应的计算:根据热化学方程式的数据列比例关系式。
24、(09届南阳三仓高三化学联考) (14分)⑴北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
①丙烷脱氢可得丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。

 ②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应总方程式为
②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应总方程式为
;放电时,CO32-移
向电池的 (填“正”或“负”)极。
⑵反应A(g)+B(g) 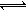 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
①该反应是_______________反应(填“吸热”“放热”);
②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小”“不变”);
③反应体系中加入催化剂对反应热是否有影响?_____________,原因是______________
______________________________________________________________________ ____。
答案:
⑴ ①124.2 ②C3H8+5O2=3CO2+4H2O 负
⑵ ①放热 ②减小 减小
③不影响 催化剂不改变平衡的移动
[学法导航]
本专题的复习同学们应该抓住以下几点的复习:
(1) 正确书写热化学方程式:
热化学方程式书写注意事项:
①、 △H只能写在标有反应物和生成物状态的化学方程式的右边,并用“;”隔开。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/mol。
②、
注意反应热△H与测定条件(温度.压强等)有关。因此书写热化学方程式时应注明△H的测定条件 绝大多数△H是在25℃.101325Pa下测定的,可不注明温度和压强。
绝大多数△H是在25℃.101325Pa下测定的,可不注明温度和压强。
③、 注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子 或原子数。因此化学计量数可以是整数.也可以是分数。
④、 注意反应物和产物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。热化学方程式中不用↑和↓。
注意热化学方程式是表示反应已完成的数量。由于△H与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应向逆向进行时,其反应热与正反应的反应热数值相等,符号相反
(2) 盖斯定律的应用:
反应热计算的常见类型及方法:
23、(河南省实验中学高三年级2008-2009学年上期期中考试)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
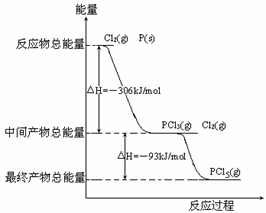 根据右图回答下列问题:
根据右图回答下列问题:
(1)原子最外层电子均达到8电子结构的分子是
(选填“PCl3”或“PCl5”)。
(2)P和Cl2反应生成PCl3的热化学方程式
______ _。
(3) PCl5分解成PCl3和Cl2的热化学方程式__________________ _ 。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________ ___ __。
答案:
.(1)PCl3
(2) P(s)+Cl2(g)=== PCl3(g);△H=-306kJ·mol-1
(3) PCl5(g)===PCl3(g)+Cl2(g);△H=+93kJ·mol-1
(4)PCl5+4H2O===H3PO4+5HCl。
22、现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。
请回答下列问题:
(1)元素B在周期表中的位置是_____________________,元素D的原子结构示意图为_________________________。
(2)A、D、E 3种元素形成一种离子化合物,其水溶液呈碱性,试用离子方程式表示该溶液中存在的所有平衡______________________________________
________________________________________________________________。
(3)A2C比A2E沸点高的原因是______________________________________。
(4)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池正极的电极反应式为_________________________________,负极的电极反应式为______________________________;该电池在放电过程中,电解质溶液的pH将___________(填“增大”、“减小”或“不变”)。
(5)化合物B2A4和B2C4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染。1 mol B2A4与B2C4完全反应生成两种气体时放出热量516.8 kJ,则该反应的热化学方程式为
_________________________________________________________________。
答案:
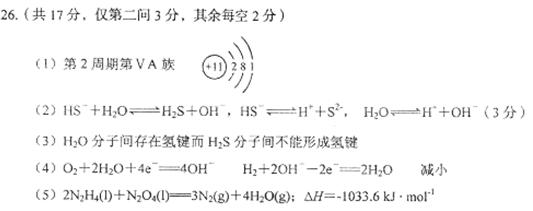
21、(重庆北山中学高2009级08-09学年度上期期末) (14分)反应A(g)+B(g) C(g)
+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)
+D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),
原因是________________________________________________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_____________________________。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_____,E2______(填“增大”“减小”“不变”)。
答案:
(1)放热。
(2)减小;该反应正反应为放热反应,升高温度使平衡向逆反应方向移动。
(3)不影响;催化剂不改变平衡的移动。
(4)减小、减小。
20、(重庆北山中学高2009级08-09学年度上期期末)工业上制备纯硅反应的热化学方程式如下: SiCl4(g)+2H2(g)===Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
答案:D
19、以NA代表阿伏加德罗常数,有关反应( )
C2H2(g)+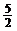 O2(g)→2CO2(g)+H2O(l);ΔH= -1300kJ/mol
O2(g)→2CO2(g)+H2O(l);ΔH= -1300kJ/mol
下列关于热化学方程式的说法正确的是
A.有5NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有4NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com