
29、(14分)下表是A、B、C、D四种有机物的有关信息;
|
A |
B |
C |
D |
|
①由C、H、O三种元素组成 ②球棍模型为: 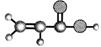 ③能与NH3在一定条件下反应生成丙烯酰胺 (CH2=CH-CONH2) |
①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与A反应生成相对分子质量为100的酯 |
①相对分子质量与B相同 ②能被弱氧化剂氢氧化铜氧化 ③能与NaHCO3溶液反应放出CO2气体 |
①能使溴的四氯化碳溶液退色 ②能与水在一定条件下反应生成B |
请回答下列问题:
(1)与D在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n。当n=__________时,开始出现该类有机物的同分异构体。
(2)在一定条件下,D分子之间能生成一种具有广泛用途的高分子化合物,写出该高分子化合物的名称是________ 。
(3)写出A与NH3在一定条件下反应生成丙烯酰胺的化学方程式,并指出反应类型:
,反应类型: 。
(4)丙烯酰胺有多种同分异构体,试写出3种分子中同时含有醛基(-CHO)和碳碳双键的同分异构体的结构简式: 、________________、_____________。
广西省平乐中学高2010级高三10月月考理科综合能力测试
生物 第Ⅱ卷(共42分)
28、(12分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验
 过程为:
过程为:
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧杂铜时所需要的仪器有
A.蒸发皿 B.石棉网 C.泥三角 D.表面皿 E.玻璃棒 F.试管夹 G.坩埚 H.铁架台
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能
原因是 。
A.灼烧过程中部分氧化铜被还原 B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜 D.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、
、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:
、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次;
若测定结果x值偏高,可能的原因是 。
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却 d.胆矾晶体部分风化
(6)现有含铜质量分数72%的杂铜50g,通过途径Ⅱ溶解在200g稀硫酸中并恰好完全反应(杂质不参与反应),过滤除去杂质,将滤液加热蒸发50g水后再降温至20℃可析出CuSO4·5H2O晶体 g
(20℃硫酸铜溶解度16.67或50/3g)
27.(20分)Ⅰ、室温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题。
(1)若由0.2mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH>7,则混合溶液中各种离子浓度由大到小的顺序是: 。
(2)若HA为弱酸,现有两组溶液
A组:由0.4mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH<7;
B组:0.1mol/L的HA溶液
① A组溶液pH<7的原因:
此时混合溶液中除水分子外的各种微粒浓度由大到小的顺序是:
。
②两组溶液中c(A-)的大小, A组 B组(填“>”“ <”或“ =”);溶液中水的电离程度A组 B组(填“>”“ <”或“ =”)。
(3)若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
(填选项番号字母)。
A.若反应后溶液呈中性,则c(OH-)+c(H+)=2×10-7mol/L
B.若V1= V2,反应后溶液一定呈中性
C.若反应后溶液呈酸性,则V1一定大于 V2 D.若反应后溶液呈碱性,则V1一定小于 V2
(4)若HA为强酸,若是pH=2 HA V1mL与pH=12 Ba(OH)2 V2 mL混合后得到pH=11的溶液,则V1/V2= 此
时溶液中离子浓度由大到小的顺序为:
Ⅱ、现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3;②NaHCO3;③NaAlO2;④CH3COONa;⑤NaOH
已知:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是 (填编号)。将五种溶液稀释相同的倍数时,
其pH变化最大的是 (填编号);
(2)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是______________(填编号);
(3)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,现象为:
写出该反应的离子方程式
26、(14分)A、B、C、D、E、F属于短周期主族元素。A的原子半径是短周期中最大,B元素的原子最
外层电子数为m,次层电子数为n,C元素的原子L层电子数为m+n,M层电子数m-n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1,F的一种原子中,质量数与质子数之差为零。
⑴B2-的离子结构示意图 ,DE2的电子式 ,该分子属于 分
子(填“极性”或“非极性”)
⑵A、B、E形成的简单离子的半径由大到小的顺序为 (用具体符号表示);
元素B、C、D、E形成的常见单质中,熔沸点由高到低的顺序是(填名称)
⑶由D、F可以构成的最简单的化合物W,取356g分子式为W·9H2O的化合物,将其释放的W完全燃
烧生成液态水,可放出1780.6kJ的热量,则W燃烧的热化学方程式为
⑷Fe(NO3)3溶液中通入过量EB2反应的离子方程式为:
(5)设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。有人制造了一种燃料电池,一个电极通入富含B单质的气体和少量DB2,另一电极通入液化石油气(以C4H10表示)电池的电解质是熔融K2CO3。电池的负极反应式为 ,电池工作时,电解质里的CO32-向 极移动。
(6)120℃,将ag DF2B、D2F6B、DB混合物在氧气流中不断用电火花点燃,得到的产物通入足量的Na2O2中,充分反应后Na2O2增重的质量wg,则wg范围为
25. (20分)如图所示,在光滑水平长直轨道上有A、B两个绝缘体,它们之间有一根长为l的轻质软线
(20分)如图所示,在光滑水平长直轨道上有A、B两个绝缘体,它们之间有一根长为l的轻质软线
相连接,其中A的质量为m,B的质量为M=4m,A为带有电荷量为q的正电荷,B不带电,空间存
在着方向水平向右的匀强电场,场强大小为E。开始时用外力把A与B靠在一起并保持静止,某时刻
撤去外力,A开始向右运动,直到细线绷紧。当细线被绷紧时,两物体将有极短时间的相互作用,而
后B开始运动,且细线再次松弛。已知B开始运动时的速度等于线
刚绷紧前瞬间A的速度的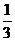 。设整个过程中,A的电荷量都保持不
。设整个过程中,A的电荷量都保持不
变。求(1)细线第一次被绷紧的瞬间,A的速度?(2)细线第二次被绷紧的瞬间B对地的位移(相对于初始点)。
广西省平乐中学高2010级高三10月月考理科综合能力测试
化学 第Ⅱ卷(共60分)
24.(19分)A、B两个矩形木块用轻弹簧相连接,弹簧的劲度系数为k,木块A的质量为m,木块B的质
量为2m。将它们竖直叠放在水平地面上,如图所示。
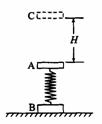 (1)用力将木块A缓慢地竖直向上提起,木块A向上提起多大高度时,木块B将离
(1)用力将木块A缓慢地竖直向上提起,木块A向上提起多大高度时,木块B将离
开水平地面?
(2)如果使另一块质量为m的物块C从距木块A高H处自由落下,C与A相碰后,
立即与A粘在一起,不再分开,再将弹簧压缩,此后,A、C向上弹起,最终能
使木块B刚好离开地面。木块C自由落下的高度H为多少?
23.(16分)在用高级沥青铺设的高速公路上,汽车的设计时速是108km/h。汽车在这种路面上行驶时,
它的轮胎与地面的最大静摩擦力等于车重的0.6倍。如果汽车在这种高速路的水平弯道上拐弯,假设弯
道的路面是水平的,其弯道的最小半径是多少?如果高速路上设计了圆弧拱桥做立交桥,要使汽车能够
安全通过圆弧拱桥(汽车不能脱离地面),这个圆弧拱桥的半径至少是多少?(取g=10m/s2)
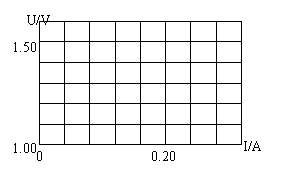
2.在测定电源电动势和内阻的实验中某同学所用电路图和测得的数据如下(每空2分,作图2分):
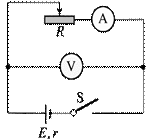 (1)实验误差分系统误差和偶然误差两种.该实验的系统误差主要
(1)实验误差分系统误差和偶然误差两种.该实验的系统误差主要
是由________引起的
(2)用给出的数据画出U-I图线,从你作出的图象中可以发现该同
学记录的第 组数据有误.
(3)求得电动势E= V,内阻r= Ω.(均保留2位有效数字)
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
U/V |
1.42 |
1.36 |
1.08 |
1.21 |
1.14 |
1.07 |
|
I/A |
0.04 |
0.08 |
0.12 |
0.16 |
0.20 |
0.24 |
1.请根据“研究平抛运动”的学生实验的目的及要求回答下列问题(第1空1分,第2、3、4空每空2分)
(1)在实验中,让小球多次从斜槽上同一位置静止滚下,在白纸上依次记下小球的位置,就可描出物体运动的轨迹,某甲和某乙得到的记录纸分别如图甲、乙所示,从图中明显地看出:
甲的实验错误是
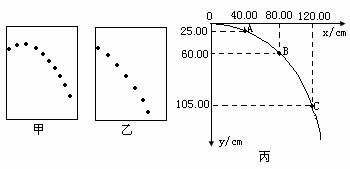
(2)某同学在做该实验时,忘了记录抛出点O点,但他准确在竖直墙上记录了抛物线轨迹的一部分,
如图丙所示(O点不是抛出点),x轴沿水平方向,由图中所给的数据可求出平抛物体的初速度大小是_______m/s,抛出点的坐标为x=________cm,y=__________cm。(g取10m/s2)。
22.实验题(共两小题,第1题7分,第2题10分,共17分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com