
7.(14分)A、B、C、D、E 5种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3:4,E原子的电子层数等于最外层电子数,D的原子序数小于E。请用化学用语回答相关问题:
 (1)A元素在周期表中的位置
。
(1)A元素在周期表中的位置
。
(2)比较C和E简单离子半径大小: 。
(3)元素E的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示):
;
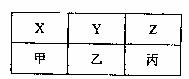 (4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形
(4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形
成的化合物,六种化合物可以排成下表,其中同一
横行的分子中电子数相同,同一纵行的物质所含元
素种类相同,其中X、Y、甲常温常压下为气体,
Z、乙、丙常温常压下为液体。
①甲的分子式为 ,丙的电子式为 。
②乙和丙常作火箭推进器的燃料,反应后的产物无污染。已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式: 。
(5)2007年7月2日,美、德两国科学家成功合成了具有独特化学特性的E2D6化合物,写出它在C2中完全燃烧的化学方程式: 。
6.将l1.2g的Mg-Cu混合物完全溶解于足量的硝酸中,收集反 应产生的x气体(假定产生的气体全部逸出)。再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀。根据题意推断气体X的成分可能是 ( )
应产生的x气体(假定产生的气体全部逸出)。再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀。根据题意推断气体X的成分可能是 ( )
A.0.3mol NO2和0.3mol NO B.0.1mol NO、0.2mol NO2 和0.05mol N2O4
NO2 和0.05mol N2O4
C.0.2mol NO2和0.1mol N2O4 D.0.6mol NO
第Ⅱ卷
本卷共4题。共64分
5.设NA代表阿伏加德罗常数的值,下列叙述正确的是 ( )
A.0.1mol铁粉与足量的高温水蒸气作用,生成的H2分子数为0.1NA
B.室温,IL pH=4的醋酸溶液中,由水电离产生的H+为l0-4NA
C.0.1 mol甲基(-CH3)所含质子数为9NA
D.标准状况下,22.4LCH2Cl2中含有的Cl原子数为2NA
4.镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应:Mg+2H++H2O2 Mg2++2H2O。关于该电池说法正确的是( )
A.放电时H+ 在正极反应得电子 B.正极反应式为:H2O2
在正极反应得电子 B.正极反应式为:H2O2 +2e-
+2e- 2OH-
 C.镁合金为屯池负极,发生氧化反应 D.电池工作时,电解质溶液的pH降低
C.镁合金为屯池负极,发生氧化反应 D.电池工作时,电解质溶液的pH降低
3.下列叙述不正确的是 ( )
A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B.一定温度下,IL lmol/L的氨水 与2L 0.5moFL的氨水中,n(NH4+)前者多
与2L 0.5moFL的氨水中,n(NH4+)前者多
C.相同体积、相同物质的量浓度的盐酸、醋酸,稀释相同倍数后,溶液的pH:盐酸<醋酸
D.0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,一定有:a(H+)+c(K+)=c(OH-)+c(X-)
2.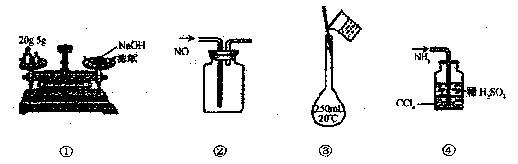 下列各图所示的实验方法正确的是 ( )
下列各图所示的实验方法正确的是 ( )
A.①称量氢氧化钠固体 B.②收集NO气体
C.③配制100mL 0.10mol/L 盐酸 D.④吸收多余的NH3
1.下列说法正确的是 ( )
A.在使用浓硝酸时,如不慎溅到皮肤上,皮肤会显黄色,是由于浓硝酸与蛋白质发生了颜色反应
B.酸性食物指的是在味觉上具有酸味的食物
C.光导纤维、玻璃纤维、合成纤维都属于高分子化合物
D.解决“白色污染”最有效的办法是直接焚烧,可回收热能用于加热或发电等
2.本卷共6题,每题6分,共36分。 在每题列出的四个选项中,只有一项是最符合题目要求的。
在每题列出的四个选项中,只有一项是最符合题目要求的。
以下数据可供解题时参考:
相对原子质量: H 1 C 12 N 14 O 16 Mg 24 S 32 Fe 56 Cu 64
39.读太阳黑子与年降水量的相关性图,回答下列问题(7分)
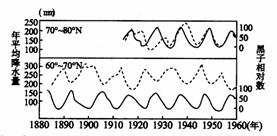
(1)在70º-80ºN测站测得的降水量变化与黑子相对数之间的关系是
;在60º-70ºN测站观测到的降水量变化与黑子相对数之间的关系是 。
(2)从图中反映出许多地区降水量的年际变化与 有一定相关性,其变化周期约为 年。
(3)根据所学知识,你认为下列哪些部门应加强对太阳活动的研究和预报
( )(多选题)
A、通信部门
B、航天部门
C、冶金工业部门
38.读下面的图①和图②,回答下列问题。(4分)
(1)3月21日至6月22日地球运行在公转轨道A、B、C、D四段中的___段(见图①)。
(2)此时段太阳直射点移动箭头的代号是_____(见图②)。
(3)地球表面太阳直射范围的大小是由______决定的。
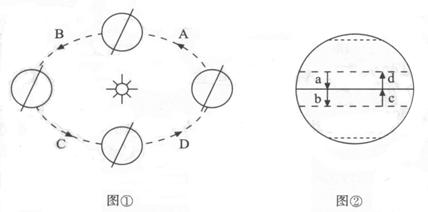 (4)在图①中标上地球自转方向
(4)在图①中标上地球自转方向
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com