
3、蓝:Cu2+(aq)、CuSO4·5H2O、
[石蕊遇碱变蓝、氨气遇湿红色石蕊试纸变蓝、淀粉遇碘变蓝]
2、黄:硫、FeS2 Na2O2、AgBr、AgI、Fe3+(aq)、碘水
[钠的焰色反应、蛋白质遇浓硝酸变黄]
1、红:Fe2O3、Fe(OH)3、Fe(SCN)3、Cu2O、品红、液溴、[酚酞遇碱变红、石蕊遇酸变红、二氧化硫品红溶液加热变红]
21、有机物的转换关系
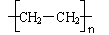 (1)CH3CH3 → CH3CH2Cl → CH2=CH2 → CH3CH2OH → CH2=CH2 → CH3CH2Br → CH3CH2OH → CH3CHO → CH3COOH → CH3COOCH2CH3 → CH3CH2OH → CH2=CH2 →
(1)CH3CH3 → CH3CH2Cl → CH2=CH2 → CH3CH2OH → CH2=CH2 → CH3CH2Br → CH3CH2OH → CH3CHO → CH3COOH → CH3COOCH2CH3 → CH3CH2OH → CH2=CH2 →
(2)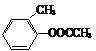 →
→ 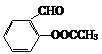 →
→ 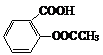 →
→ 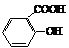 →
→  →
→ 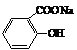 →
→ 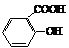 →
→ 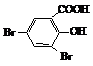
(3)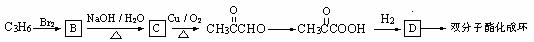
(4)淀粉 → 葡萄糖 → 酒精 → CO2
(5)、由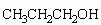 制
制 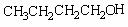
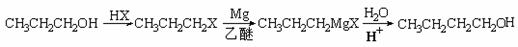
(6)、丁烯酸聚合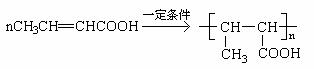
(7)、HOOCCH=CHCOOH + 2CH3OH浓硫酸Δ CH3OOCCH=CHCOOCH3 + 2H2O
(9)、用电石和苯制聚苯乙烯塑料
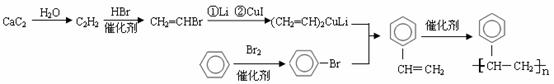
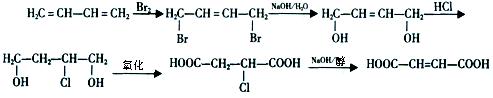
(10)、由丁二烯制 
(11)、由苯酚制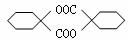
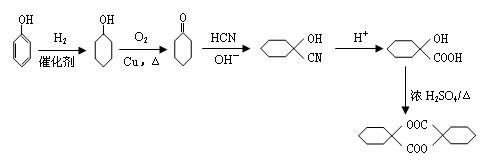
20、有机反应类型
取代反应:CH4+Cl2 、CH3CH2Br与NaOH水溶液、CH3CH2OH与HBr、苯与液溴、苯与浓硝酸、苯酚与浓溴水、乙醇与醋酸
水解反应:溴乙烷、乙酸乙酯、庶糖、淀粉与水的反应
加成反应:乙烯与溴水、乙烯与氢气、乙烯与水、乙炔与溴水、乙醛与氢气、苯与氢气
消去反应: 乙醇与浓硫酸并加热、溴乙烷与氢氧化钠的醇溶液并加热
酯化反应:醇与酸反应生成酯和水
加聚反应:乙烯聚合
氧化反应:CH3CH2OH → CH3CHO → CH3COOH
银镜反应:乙醛、葡萄糖;有机物燃烧
还原反应:不饱和键(双键、三键、苯环、C=O)加氢
19、NH4Cl、CuSO4、FeCl3、AlCl3、Na2CO3、NaHCO3、醋酸钠、苯酚钠
制金属:电解法-Na、Mg、Al ;CO还原法-Fe;铝热法-Mn、Cr、V
海水提碘:海带-海带灰-滤液-通氯气-萃取-蒸馏-碘。
粗盐提纯:粗盐-溶解-过量BaCl2-过量Na2CO3-过滤-适量盐酸-蒸发结晶。
制胆矾(CuSO4·5H2O):粗铜粉-O2+稀硫酸-过滤-蒸发制热饱和溶液-冷却结晶。
制绿矾(FeSO4·7H2O):废铁屑-Na2CO3除油-稀硫酸(50~70℃)-趁热过滤-冷却结晶-洗涤-吸干水。
实验设计:①CuSO4·5H2O → 无水CuSO4 ,CuSO4 溶液制取CuSO4·5H2O
②MgCl2溶液 →MgCl2·6H2O, MgCl2·6H2O→无水MgCl2 ,无水MgCl2配制MgCl2溶液等应注
意实验事项(氯化铝、氯化铁与其相拟)
③ 用氢氧化钠溶液制取碳酸氢钠溶液
④ 比较均为0.1mol/L盐酸和醋酸的酸性强弱
18、电解氯化铜溶液、电解饱和食盐水、精炼铜、电解氯化镁、电解氧化铝、电解硫酸钠溶液、电解氢氧化钠溶液、电解硝酸银溶液;牺牲阳极法防止金属腐蚀。
17、铜-锌(硫酸)电池、铅蓄电池、氢氧燃料电池(氢氧化钾)、甲醇燃料电池(氢氧化钾)、锌-氧化银(氢氧化钾)电池;金属的电化腐蚀。
16、Na2S2O3 + H2SO4 、 CaO+SiO2、KOH+CO2、 KHCO3分解、Ba(OH)2·8H2O + NH4Cl(S)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com