
2.作者认为,“成熟的富人与成熟的穷人”的标准分别是什么?“成熟的富人与成熟的穷人”的共同点是什么?
1.本文的中心论点是什么?
6.盐的主要性质
⑴溶解性
硝酸盐、碳酸氢盐、磷酸二氢盐、次氯酸盐均易溶于水。
氯化物除氯化银、氯化亚汞(AgCl、Hg2Cl2)难溶于水、氯化铅(PbCl2)微溶于水外,其它的氯化物均溶于水。
硫酸盐中除硫酸钡、硫酸铅难溶于水、硫酸银、硫酸钙微溶于水外,其它硫酸盐均溶于水
其它的酸根盐,只溶钾、钠、铵。
(一般酸式盐的溶解度大于正盐溶解度,而碳酸氢钠溶解度小于碳酸钠)
⑵稳定性
碳酸氢盐、硝酸盐均不稳定,受使热易分解,例:2NaHCO3
 Na2CO3+CO2↑+H2O,2KNO3
Na2CO3+CO2↑+H2O,2KNO3 2KNO2+O2↑、2Cu(NO3)2
2KNO2+O2↑、2Cu(NO3)2  2CuO+4NO2↑+O2↑、2AgNO3
2CuO+4NO2↑+O2↑、2AgNO3  2Ag+2NO2↑+O2↑。
ⅠA族碳酸盐稳定,其它碳酸盐在较高温度下能分解,例:MgCO3
2Ag+2NO2↑+O2↑。
ⅠA族碳酸盐稳定,其它碳酸盐在较高温度下能分解,例:MgCO3 MgO+CO2↑,CaCO3
MgO+CO2↑,CaCO3  CaO+CO2↑。
⑶与酸、碱反应
①与酸反应遵循盐与酸反应的规律,即强酸与弱酸盐反应,不挥发性酸制挥发性酸反应,
例:FeS+2HCl=FeCl2+H2S↑,2NaCl(固)+H2SO4(浓)
CaO+CO2↑。
⑶与酸、碱反应
①与酸反应遵循盐与酸反应的规律,即强酸与弱酸盐反应,不挥发性酸制挥发性酸反应,
例:FeS+2HCl=FeCl2+H2S↑,2NaCl(固)+H2SO4(浓) Na2SO4+2HCl↑。
注意特殊性:由于PbS、CuS、HgS、Ag2S既不溶于水,也不溶于生成的强酸中,所以氢硫酸可与Pb2+、Cu2+、Hg2+、Ag+的盐反应,例:CuSO4+H2S=CuS↓+H2SO4。
②与碱反应
酸式盐与碱反应是中和反应的继续。例:NaHCO3+NaOH=Na2CO3+H2O
(弱酸的酸式盐既与酸反应,又与碱反应,例:NaHCO3+HCl=NaCl+CO2↑+H2O)
⑷氧化性、还原性
①氧化性:硝酸盐在一定条件下具有氧化性,例:S+2KNO3+3C
Na2SO4+2HCl↑。
注意特殊性:由于PbS、CuS、HgS、Ag2S既不溶于水,也不溶于生成的强酸中,所以氢硫酸可与Pb2+、Cu2+、Hg2+、Ag+的盐反应,例:CuSO4+H2S=CuS↓+H2SO4。
②与碱反应
酸式盐与碱反应是中和反应的继续。例:NaHCO3+NaOH=Na2CO3+H2O
(弱酸的酸式盐既与酸反应,又与碱反应,例:NaHCO3+HCl=NaCl+CO2↑+H2O)
⑷氧化性、还原性
①氧化性:硝酸盐在一定条件下具有氧化性,例:S+2KNO3+3C K2S+N2↑+3CO2↑
②还原性:亚硫酸盐、硫化物、溴化物、碘化物均具有还原性,例:2CaSO3+O2=2CaSO4,
2Na2S+Na2SO3+3H2SO4=3Na2SO4+3S↓+3H2O、2NaBr+3H2SO4(浓)=2NaHSO4+Br2+SO2↑+2H2O,
2KI+Cl2=2KCl+I2。
K2S+N2↑+3CO2↑
②还原性:亚硫酸盐、硫化物、溴化物、碘化物均具有还原性,例:2CaSO3+O2=2CaSO4,
2Na2S+Na2SO3+3H2SO4=3Na2SO4+3S↓+3H2O、2NaBr+3H2SO4(浓)=2NaHSO4+Br2+SO2↑+2H2O,
2KI+Cl2=2KCl+I2。
5.非金属含氧酸的主要性质和制备 (1)常见含氧酸的性质与制备
|
物质
项目 |
H2CO3 |
H4SiO4
H2SiO3 |
HNO3 |
H3PO4 |
H2SO4 |
H2SO3 |
HClO4 |
HClO |
|
|||||||
|
物理性质 |
挥发性酸 |
无色胶状固体
白色粉末
微溶于水 |
无色、有刺激性气味(挥发性)液体,易溶于水 |
无色晶体,
难挥发,
易溶于水 |
无色、粘稠、油状液体,不易挥发,易溶于水 |
挥发性酸 |
-- |
|
||||||||
|
化学性质 |
通性 |
均具有酸的通性(与碱反应时,几元酸就可生成几种盐) |
||||||||||||||
|
稳定性 |
不稳定
H2CO3=CO2↑+H2O |
不稳定 |
较不稳定
4HNO3  4NO2↑+O2↑
+2H2O
4NO2↑+O2↑
+2H2O |
稳定 |
稳定 |
不稳定
H2SO3=
SO2↑+H2O |
-- |
不稳定
2HClO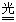 2HCl+O2↑
2HCl+O2↑ |
||||||||
|
酸性 |
弱酸 |
极弱酸 |
强酸 |
中强酸 |
强酸 |
中强酸 |
含氧酸中最强的酸 |
弱酸 |
||||||||
|
氧化性 |
-- |
-- |
浓、稀HNO3均具有强氧化性
冷、浓HNO3可使Fe、Al钝化 |
-- |
浓H2SO4具有强氧化性,冷、浓H2SO4可使Fe、Al钝化 |
-- |
氧化性酸 |
强氧化性 |
||||||||
|
|
其它 |
-- |
-- |
王水:
V(HNO3)∶V(HCl)=1∶3
可氧化Pt、Au |
易潮解 |
浓硫酸有脱水性、吸水性 |
漂白性
还原性 |
|
漂白性 |
|||||||
|
制备 |
现用现制 CaCO3+2HCl=CaCl2+CO2↑+H2O
 |
Na2SiO3+
2HCl=2NaCl
+H2SiO3↓ |
工业:
4NH3+5O2 4NO+6H2O
2NO+O2=2NO2
3NO2+H2O
=2HNO3+NO
实验室:
NaNO3(固)+
H2SO4(浓) 4NO+6H2O
2NO+O2=2NO2
3NO2+H2O
=2HNO3+NO
实验室:
NaNO3(固)+
H2SO4(浓) NaHSO4+HNO3↑ NaHSO4+HNO3↑ |
工业:
Ca3(PO4)2+
3H2SO4=
3CaSO4+
2H3PO4 |
工业:
4FeS2+11O2 2Fe2O3+8SO2
2SO2+O2
2Fe2O3+8SO2
2SO2+O2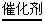 2SO3
SO3+H2O=H2SO4 2SO3
SO3+H2O=H2SO4 |
Na2SO3+H2SO4=
Na2SO4+
SO2↑+H2O |
-- |
|
||||||||
(2)酸性强弱规律: ①对于同种非金属形成的不同含氧酸,其非金属的价态越高,酸性越强。如HClO4>HClO3>HClO2>HClO,H2SO4>H2SO3,HNO3>HNO2。 ②证明酸性强弱顺序,可用“强酸制弱酸”的规律。如: Na2SiO3+CO2+2H2O=Na2CO3+H4SiO4↓(水玻璃敝口放置变浑浊) Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO(漂白粉遇CO2产生HClO) ③常见酸的酸性强弱顺序:
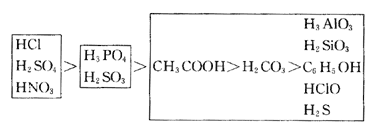
4.非金属氧化物
非金属氧化物的性质和制法
|
|
CO |
CO2 |
SiO2 |
NO |
NO2 |
P2O5 |
SO2 |
SO3 |
|
|
类别 |
不成盐
氧化物 |
碳酸酐 |
硅酸酐 |
不成盐
氧化物 |
特殊氧化物 |
偏磷酸及
磷酸酸酐 |
亚硫酸酐 |
硫酸酐 |
|
|
晶体
类型 |
分子晶体 |
原子晶体 |
分子晶体 |
||||||
|
物理性质 |
色态味 |
无色无味气体 |
无色晶体 |
无色气体 |
红棕色、
刺激性
气味气体 |
白色固体 |
无色刺激性
气味气体 |
无色晶体 |
|
|
溶解性 |
难溶于水 |
能溶于水
1∶1 |
难溶于水 |
难溶于水 |
易溶于水
并与水反应 |
易溶于水
并与水反应 |
易溶于水
(1∶40)
并与水反应 |
易溶于水
并与水反应 |
|
|
熔沸点 |
低 |
高 |
低 |
||||||
|
毒性 |
有毒 |
无毒 |
无毒 |
有毒 |
有毒 |
无毒 |
有毒 |
无毒 |
|
|
化学性质 |
与水 |
CO+H2O
 CO2+H2
(氧化还原反应) CO2+H2
(氧化还原反应) |
 |
-- |
3NO2+H2O=2HNO3+NO
4NO+3O2+2H2O=4HNO3
4NO2+O2+2H2O=4HNO3 |
P2O5+H2O(冷)=2HPO3
P2O5+3H2O(热)=2H3PO4 |
 |
SO3+H2O
=H2SO4 |
|
|
与碱性氧化物 |
-- |
CO2+Na2O
= Na2CO3 |
SiO2+CaO
 CaSiO3 CaSiO3 |
-- |
-- |
P2O5+3CaO=
Ca3(PO4)2 |
SO2+CaO=
CaSO3 |
SO3+Na2O
=Na2SO4 |
|
|
与碱 |
-- |
CO2+Ca(OH)2
=CaCO3↓+H2O
2CO2+Ca(OH)2
=Ca(HCO3)2 |
SiO2+2NaOH
=Na2SiO3+H2O |
2NO2+2NaOH=
NaNO3+NaNO2+H2O
NO+NO2+2NaOH=
NaNO3+H2O
(氧化还原反应) |
P2O5+6NaOH=
2Na3PO4+3H2O |
SO2+2NaOH=
Na2SO3+H2O
SO2+NaOH=
NaHSO3 |
SO3+2NaOH=
Na2SO4+H2O |
||
|
|
氧化性 |
-- |
CO2+C
 2CO
CO2+2Mg
2CO
CO2+2Mg
 MgO+C
MgO+C |
SiO2+2C
 Si+2CO↑ Si+2CO↑ |
6NO+4NH3  5N2+6H2O 2NO+2CO 5N2+6H2O 2NO+2CO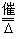 N2+2CO2 N2+2CO2 |
NO2+SO2=
NO+SO3 |
―― |
SO2+2H2S=
3S+2H2O |
强氧化性 |
|
还原性 |
CO+CuO Cu+CO2
2CO+O2
Cu+CO2
2CO+O2  2CO2
2CO2 |
-- |
-- |
2NO+O2=2NO2 |
NO2能使酸性
KMnO4溶液褪色 |
-- |
2SO2+O2
 2SO3
SO2+NO2=
NO+SO3
2SO3
SO2+NO2=
NO+SO3 |
-- |
|
|
其它 |
|
CO2+H2O+CaCO3
=Ca(HCO3)2 |
SiO2+4HF
=SiF4↑+2H2O
SiO2+CaCO3 CaSiO3+CO2↑ CaSiO3+CO2↑ |
-- |
 |
|
具有漂白性,
能使品红褪色 |
|
|
|
制法
|
工业:
C+H2O CO+H2
CO2+C
CO+H2
CO2+C 2CO
2CO
|
实验室:
CaCO3+2HCl
=CaCl2+CO2↑+H2O
|
--
|
工业:
4NH3+5O2 4NO+6H2O
实验室:
3Cu+8HNO3
4NO+6H2O
实验室:
3Cu+8HNO3 3Cu(NO3)2
+2NO↑
+4H2O 3Cu(NO3)2
+2NO↑
+4H2O
|
实验室:
Cu+4HNO3(浓)=Cu(NO3)2+
2NO2↑+2H2O
|
4P+5O2  2P2O5
2P2O5
|
工业:
4FeS2+11O2
 2Fe2O3+8SO2
实验室:
Na2SO3+H2SO4
(浓)=
Na2SO4+SO2↑
+H2O
2Fe2O3+8SO2
实验室:
Na2SO3+H2SO4
(浓)=
Na2SO4+SO2↑
+H2O
|
工业:
2SO2+O2
 2SO3
2SO3
|
3.非金属气态氢化物
非金属氢化物的结构、性质和制法
|
|
|
CH4 |
SiH4 |
NH3 |
PH3 |
H2S(H2O) |
HX |
||
|
结构 |
晶体类型 |
均为分子晶体 |
|||||||
|
分子结构 |
正四面体形 |
三角锥形 |
折线形 |
直线形 |
|||||
|
键角 |
109º28' |
107º18' |
92º(104º30') |
180° |
|||||
|
物理性质 |
色态 |
常温常压下,H2O为无色液体,其余为无色气体 |
|||||||
|
溶解性 |
难溶于水 |
极易溶于水
(1∶700) |
难溶 |
能溶于水
(1∶2.6) |
均极易溶于水
HCl(1∶500) |
||||
|
毒性 |
无毒 |
毒 |
剧毒 |
HF有毒 |
|||||
|
化学性质 |
稳定性 |
稳定 |
极不
稳定 |
稳定 |
极不
稳定 |
不稳定 |
由HF→HI稳定性
逐渐减弱 |
||
|
可燃性 |
可燃 |
自燃 |
在纯O2中燃烧
4NH3+3O2
 2N2+6H2O
2N2+6H2O |
自燃 |
2H2S+O2
 2S+2H2O
2H2S+3O2
2S+2H2O
2H2S+3O2
 2SO2+2H2O
2SO2+2H2O |
不燃烧 |
|||
|
水溶液的酸碱性 |
-- |
-- |
弱碱性
 |
-- |
弱酸性
 |
 HF弱酸性
其它为强酸:
HCl=H++Cl-
HBr=H++Br-
HI=H++I-
HF弱酸性
其它为强酸:
HCl=H++Cl-
HBr=H++Br-
HI=H++I- |
|||
|
氧化还原性 |
常温下不易被氧化:如不能使
酸性KMnO4溶液褪色 |
自燃时为还原性 |
常温不易被氧化
4NH3+5O2
 4NO+6H2O
8NH3+3Cl2=
N2+8NH4Cl
4NO+6H2O
8NH3+3Cl2=
N2+8NH4Cl |
自燃中表现还原性 |
主要表现还原性
2H2S+SO2=3S+2H2O
H2S+H2SO4(浓)=S↓+SO2↑+2H2O
H2S+I2=S↓+2HI
…… |
由HF→HI
还原性增强
MnO2+4HCl(浓)
 MnCl2
Cl2↑ +2H2O
HBr、HI能被浓
H2SO4氧化
2HBr+H2SO4(浓)
=Br2+SO2↑+
2H2O
2HI+H2SO4
(浓)=I2+
SO2↑+2H2O MnCl2
Cl2↑ +2H2O
HBr、HI能被浓
H2SO4氧化
2HBr+H2SO4(浓)
=Br2+SO2↑+
2H2O
2HI+H2SO4
(浓)=I2+
SO2↑+2H2O |
|||
|
其它 |
取代反应
CH4+Cl2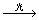 CH3Cl+HCl
CH4
CH3Cl+HCl
CH4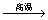 C+
2H2 C+
2H2 |
-- |
NH3+H+=NH4+
NH3与CaCl2按8∶1络合,因此不能用CaCl2干燥NH3 |
-- |
H2S可与某些强酸盐反应
Pb(NO3)2+H2S=PbS↓
+2HNO3
CuCl2+H2S=CuS↓
+2HCl
Hg(NO3)2+H2S=HgS↓+2HNO3
2AgNO3+H2S=Ag2S↓
+2HNO3 |
HF可腐蚀玻璃
4HF+SiO2=
SiF4↑+2H2O |
|||
|
制备 |
CH3COONa
+NaOH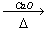 CH4↑+Na2CO3
CH4↑+Na2CO3 |
Mg2Si+
4HCl=
SiH4↑
+2MgCl2 |
工业:
N2+3H2 2NH3
实验室:
2NH4Cl+Ca(OH)2
2NH3
实验室:
2NH4Cl+Ca(OH)2 2NH3↑+2H2O
+CaCl2 2NH3↑+2H2O
+CaCl2 |
-- |
FeS+H2SO4=FeSO4
+H2S↑
FeS+2HCl=FeCl2
+H2S↑
(不能用浓H2SO4和HNO3) |
工业:
H2+Cl2
 2HCl
实验室:
CaF2+H2SO4(浓)
2HCl
实验室:
CaF2+H2SO4(浓)
 CaSO4+2HF↑
(在铅皿中进行)
NaCl+H2SO4(浓)
CaSO4+2HF↑
(在铅皿中进行)
NaCl+H2SO4(浓)
 NaHSO4+HCl↑
NaHSO4+NaCl
NaHSO4+HCl↑
NaHSO4+NaCl
 Na2SO4+HCl↑
NaBr+H3PO4(浓)
Na2SO4+HCl↑
NaBr+H3PO4(浓)
 NaH2PO4+HBr↑
(制HBr、HI用
它们的盐分别
与H3PO4反应,
不能用浓H2SO4)
NaH2PO4+HBr↑
(制HBr、HI用
它们的盐分别
与H3PO4反应,
不能用浓H2SO4) |
|||
|
|
|
|
|
|
|
|
|
|
|
45. “The interest _________ be divided into five parts, according to the agreement made by both sides,” declared the judge.
A. may B. should C. must D. shall
Keys:
1-5 ADDDC 6-10 ABDAA 11-15 DCDBB 16-20 BAACC 21-25 AABAC 26-30 CBDBB 31-35 BCBCA 36-40 BAAAD 41-45 BABDD
44. I ____ ping-pong quite well, but I haven’t had time to play since the new year.
A. will play B. have played C. played D. play
43. Hospital staff burst into cheers after doctors completed a 20-hours operation to have ______ one-year-old twins at the head.
A. isolated B. separated C. divided D. removed
42. We didn’t plan our art exhibition like that but it ____ very well.
A. worked out B. tried out
C. went on D. carried on
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com