
2.一根粗细均匀的镍铬丝的横截面的直径为d,电阻是R,把它拉制成直径是的均匀细丝后,它的电阻变成( )
A.R B.10000R
C.R D.100R
解析:R=ρ
拉长后L′==100L
故R′=ρ=10000R.
答案:B
1.用一个内阻不计的电源和三根电热丝加热一壶水,已知电热丝的电阻R1=R2>R3,则加热最快的方法是( )
A.三根电热丝并联
B.三根电热丝串联
C.R1、R3并联再与R3串联
D.R2、R3并联再与R3串联
解析:三根电热丝并联时,三根电热丝的电功率之和最大,大小为:P总=U2(++).
答案:A
7.在静电场中( )
A.电场强度处处为零的区域内,电势也一定处处为零;
B.电场强度处处相同的区域内,电势也一定处处相同;
C.电场强度的方向总是跟等势面垂直的;
D.沿着电场强度的方向,电势总是不断降低的.
6.一个带正电的质点,电量q=2.0×10-9库,在静电场中由a点移到b点,在这过程中,除电场力外,其他力作的功为6.0×10-5焦,质点的动能增加了8.0×10-5焦,则a、b两点间的电势差Ua-Ub为( )
A.3×104伏; B.1×104伏;
C.4×104伏; D.7×104伏。
5.若带正电荷的小球只受到电场力作用,则它在任意一段时间内( )
A.一定沿电力线由高电势处向低电势处运动;
B.一定沿电力线由低电势处向高电势处运动;
C.不一定沿电力线运动,但一定由高电势处向低电势处运动;
D.不一定沿电力线运动,也不一定由高电势处向低电势处运动。
4.如图a,b,c是一条电场线上的三个点,电场线的方向由a到c,a、b间的距离等于b、c间的距离。用φa、φb、φc和Ea、Eb、Ec分别表示a、b、c三点的电势和电场强度,可以断定( )
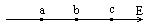 A.φa>φb>φc B.Ea>Eb>Ec
A.φa>φb>φc B.Ea>Eb>Ec
C.φa-φb=φb-φc D.Ea=Eb=Ec
3.图中A、B、C、D是匀强电场中一正方形的四个顶点,已知A、B、C三点的电势分别为φA=15V、φB=3V、φC=-3V,由此可得D点电势φD=________V

2.A、B两带电小球,A固定不动,B的质量为m。在库仑力作用下,B由静止开始运动。已知初始时,A、B间的距离为d,B的加速度为a。经过一段时间后,B的加速度变为a/4,此时A、B间的距离应为_____。已知此时B的速度为v,则在此过程中电势能的减少量为_____。
1.如图所示,Q是带正电的点电荷,P1和P2为其电场中的两点。若E1、E2为P1、P2两点的电场强度的大小,φ1、φ2为P1、P2两点的电势,则( )
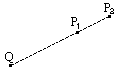 A.E1>E2,φ1>φ2 B.E1>E2,φ1<φ2
A.E1>E2,φ1>φ2 B.E1>E2,φ1<φ2
C.E1<E2,φ1>φ2 D.E1<E2,φ1<φ2
7、从转化关系寻找
如盐A有如下转化:A → B → C → D → E,D比C式量大16,E为酸。则可推知:若X为碱,则A中含NH4+;若X为酸,则A中含S2-(或HS-)。
例1、A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
|
阴离子 |
OH- Cl- CO2-3 SO2-4 HSO-4 |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是
A__________;B__________;C__________;D__________;E__________。
思路解析:从①②③可知:A与B、C、D均可产生白色沉淀,可判断出A中含有CO2-3 ,再根据CO2-3 不与Mg2+、Al3+、Ba2+共存,因而得A为Na2CO3,这样就找到了本题的突破口。①②③中的白色沉淀为MgCO3、Al(OH)3和BaCO3。而能溶解上面两种沉淀的E溶液一定是呈现酸性的硫酸氢盐溶液,其中前两种可溶于硫酸氢盐溶液,只有BaCO3不溶于硫酸氢盐溶液(隐藏条件),由此可确定③中生成的沉淀是BaCO3,同时结合④中沉淀量减少推断出D为Ba(OH)2;再根据④中的叙述,判断出B为Al2(SO4)3;又根据离子共存的知识推断出E为NaHSO4 [或Mg(HSO4)2]。最后确定C为MgCl2 [或AlCl3] 。
答案:27.A-Na2CO3,B-Al2(SO4)3,C-MgCl2 [或AlCl3],D-Ba(OH)2,E-NaHSO4 [或Mg(HSO4)2]。
例2、现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
|
阳离子 |
Ag+
Ba2+ Al3+ |
|
阴离子 |
OH-  Cl-
SO42- Cl-
SO42- |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
⑴写出化合物的化学式:A ① , C ② ,D ③ , E ④ 。
⑵A溶液与过量E溶液反应后,最终得到的沉淀的化学式是 ⑤ 。
思路解析:从a知,既不溶于水,也不溶于酸的物质是AgCl和BaSO4;通过比较 bc中“与上述某阳离子反应可生成B和D”知A和C中含有Cl- 和SO42-,而由两溶液与氨水生成白色沉淀可推知A和C阳离子均为 Al3+(可通过离子共存排除Ag+);从d知B为BaSO4(可通过E溶于水排除Ag+)、D就为AgCl,进而知A为Al2(SO4)3,C为AlCl3;最后通过e知E为Ba(OH)2
bc中“与上述某阳离子反应可生成B和D”知A和C中含有Cl- 和SO42-,而由两溶液与氨水生成白色沉淀可推知A和C阳离子均为 Al3+(可通过离子共存排除Ag+);从d知B为BaSO4(可通过E溶于水排除Ag+)、D就为AgCl,进而知A为Al2(SO4)3,C为AlCl3;最后通过e知E为Ba(OH)2
答案:Al2(SO4)3、 AlCl3、 AgCl、 Ba(OH)2、 BaSO4
从以上两题可看出:无机推断题不仅考查了多种物质间的相互转化及生成物的性质,还考查了物质的溶解性和离子共存的有关知识。将以往高考涉及的无机框图改为集离子共存、元素化合物、实验于一体的综合题,突出了对基础知识和基本技能的综合考查,体现了高考以能力立意的主导思想。这就要求在高三复习中,不仅要抓住典型元素及其化合物的性质及转化关系,还要将常见物质的溶解性及离子间的反应及能否共存等问题掌握,教师可引导学生将常见离子共存问题小结归纳(如下表所示)。
|
不能大量共存的原因 |
常见实例 |
|
(1)结合成难溶物或微溶物 |
如SO42_不能与Ba2+、Ca2+、Ag+共存 OH-、CO32–不能与Mg2+、Fe2+、Fe3+、Al3+、Zn2+ 、Cu2+等共存 Ag+不能与Cl―、Br―、 I―共存 (详见课本溶解性表) |
|
(2) 生成挥发性物质 |
如CO32–、SO32―、S2–
、HCO3―、HSO3―、HS―等与H+不能共存 |
|
(3)结合成难电离的物质(水,弱酸和弱碱) |
H+与OH-结合成水 H+与PO43–、CH3COO_、 F―、ClO―、AlO2―、C6H5-O―结合成弱酸 OH- 与酸式根如HCO3―、HSO3―、  H2PO4―生成水 H2PO4―生成水
OH-与NH4+结合成NH3·H2O |
|
(4)发生氧化还原反应 |
MnO4―、ClO―、NO3―(有H+时)与S2―、I―、Fe2+、SO32―等不能共存。 |
|
(5)能结合成络合物 |
如Fe3+与SCN―不能共存 |
|
(6)发生双水解反应 |
Fe3+、Al3+
与AlO2―、S2–、CO32–不能共存 |
例3、下图是无机物A-M在一定条件 下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
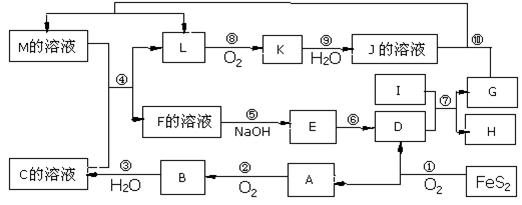
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是___(填写序号)。
(4)反应④ 的离子方程式是:______________________________________
(5)将化合物D 与KNO3、KOH 共融 ,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:
,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:
______________ ______________________________________
______________________________________ _______。
_______。
思路解析:本题的突破点是“I是由第三周期元素组成的单质中熔点最高的金属”和“K是一种红棕色气体”,可先确定I为Al,K为NO2; 第一条线索由反应①入手可知: A是SO2、B是SO3、C是H2SO4,D是Fe2O3,反 应⑦为铝热反应,则产物G是Fe。第二条线索是由K 是NO2入手,推出L是NO,J为HNO3,M是Fe和HNO3反应得到的产物,可能是Fe(NO3)3或Fe(NO3)2,而根据M与C溶液反应可生成NO气体,可断定发生了氧化还原反应,故M只能为Fe(NO3)2溶液;第三条线索是Fe(NO3)2(M)与H2SO4(C)反应得F为Fe(NO3)3,E为Fe(OH)3,到此框图中的物质全部推出。
应⑦为铝热反应,则产物G是Fe。第二条线索是由K 是NO2入手,推出L是NO,J为HNO3,M是Fe和HNO3反应得到的产物,可能是Fe(NO3)3或Fe(NO3)2,而根据M与C溶液反应可生成NO气体,可断定发生了氧化还原反应,故M只能为Fe(NO3)2溶液;第三条线索是Fe(NO3)2(M)与H2SO4(C)反应得F为Fe(NO3)3,E为Fe(OH)3,到此框图中的物质全部推出。
 物质的颜色:气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(红棕色)、NO2(红棕色)、O3(淡蓝色);液体或溶液:Fe2+ (浅绿色)Fe3+(黄色)Cu2+(蓝色)、MnO4-(紫红色)、Fe(SCN)3
(血红色)、Br2(红棕色);固体:黑色(CuO、MnO2、FeO、Fe3O4、CuS);Cu2O(红色)、Fe2O3(红棕色)、Cu(OH)2(蓝色)、CuCl2(棕色)、Fe(OH)3(红褐色)、CuSO4·5H2O(蓝色)、Na2O2(淡黄色);BaSO4、AgCl(白色沉淀)、AgBr(淡黄色)、AgI(黄色)不溶于水、不溶于酸;S(淡黄
物质的颜色:气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(红棕色)、NO2(红棕色)、O3(淡蓝色);液体或溶液:Fe2+ (浅绿色)Fe3+(黄色)Cu2+(蓝色)、MnO4-(紫红色)、Fe(SCN)3
(血红色)、Br2(红棕色);固体:黑色(CuO、MnO2、FeO、Fe3O4、CuS);Cu2O(红色)、Fe2O3(红棕色)、Cu(OH)2(蓝色)、CuCl2(棕色)、Fe(OH)3(红褐色)、CuSO4·5H2O(蓝色)、Na2O2(淡黄色);BaSO4、AgCl(白色沉淀)、AgBr(淡黄色)、AgI(黄色)不溶于水、不溶于酸;S(淡黄 色沉淀)。
色沉淀)。
单质的熔点、密度:在常温下呈液态的金属:Hg;熔点最高的非金属单质:石墨;其次是金刚石;单质在常温下呈液态的非金属单质:Br2;最轻的金属:Li。
例4、U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。(问法省略)
思路解析:本题突破点较多,可由燃烧的产物可使品红溶液褪色推出单质Y为硫元素,W2为O2 ,W为氧元素;由Z3W4具有磁性 推知其为Fe3O4,则z为铁元素;由“燃烧可生成UW和UW2两种气体”推知U为碳元素;再由“剧烈燃烧生成黑、白两种固体”可推知X为镁元素;最后由原子序数依次增大,推出V为氮元素。
推知其为Fe3O4,则z为铁元素;由“燃烧可生成UW和UW2两种气体”推知U为碳元素;再由“剧烈燃烧生成黑、白两种固体”可推知X为镁元素;最后由原子序数依次增大,推出V为氮元素。
这一题型是给出无机化学中元素单质及其重要化合物相互反应的框图,要求 推断物质的化学式或名称,写出相关反应的化学方程式或离子方程式(以氧族、氮族、卤素、钠、镁、铝、铁出现次数更多些)。这就要求我们平时多进行各种反应类型,各类相似物质性质比较,推断思路分析比较等系统的研究和小结。小结中要求穷举所有的各个反应,逐个进行分析研究,积累很多素材,了解很多的反应,记忆有规律或无规律的知识点。这样解推断题一定会更加游刃有余的。譬如我们可引导学生小结归纳常见反应的化学现象:
推断物质的化学式或名称,写出相关反应的化学方程式或离子方程式(以氧族、氮族、卤素、钠、镁、铝、铁出现次数更多些)。这就要求我们平时多进行各种反应类型,各类相似物质性质比较,推断思路分析比较等系统的研究和小结。小结中要求穷举所有的各个反应,逐个进行分析研究,积累很多素材,了解很多的反应,记忆有规律或无规律的知识点。这样解推断题一定会更加游刃有余的。譬如我们可引导学生小结归纳常见反应的化学现象:
在空气中燃烧时的火焰颜色
(1)苍白色:H2在Cl2中燃烧; (2)蓝色:CO在空气中燃烧;
(3)淡蓝色:H2S、H2、CH4、CH3CH2OH、S等在空气中燃烧;
(4)明亮的蓝紫色:S在纯氧中燃烧; (5)金属的焰色反应
烟、雾
在空气中形成白雾的:HCl、HBr、HI、NH3等气体及浓盐酸、浓硝酸;
相遇形成白烟或固体的:NH3+HCl、NH3+HBr、NH3+HNO3、H2S+SO2、H2S+Cl2;
燃烧时出现白色烟雾的:(P+Cl2);
燃烧时出现棕黄色烟的:(CuCl2)。
例5、以下一些氧化物和单质之间可以发生如下图所示的反应:
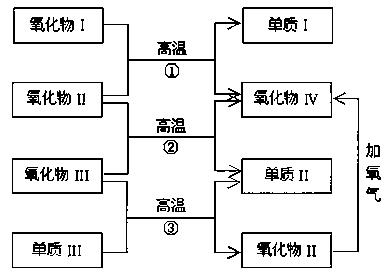
其中,氧化物(I)是红棕色固体,氧化物(II)、(III)、(IV)在反应条件下都是气体。
(1)氧化物(I)的化学式(分子式)是_____________。
氧化物(II)的化学式(分子式)是_____________。
(2)反应①的化学方程式是_____________。
反应②的化学方程式是_____________;反应③的化学方程式是_____________。
解析:本题以反应物和生成物的类型为信息考查元素化合物的推断,涉及铁、碳等单质及其化合物的知识。由“氧化物(I)是红棕色固体”推知,氧化物(I)可能是氧化铁或氧化亚铜;“氧化物(II)、(III)、(IV)在反应条件下都是气体”,中学化学中气态氧化物有:CO,CO2,SO2,NO等,注意这里有“在反应条件下”的限制,隐性信息是可能在高温下呈气态,如水蒸气和三氧化硫。
破译框图知,反应①②是“氧化物+氧化物→氧化物+单质”;反应③是“氧化物+单质→氧化物+单质”,置换反应产物是单质和化合物,但生成单质和化合物的反应不一定是置换反应,如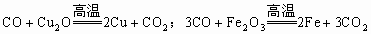 。氧化物(II)在氧气作用下生成氧化物(IV),说明这两种氧化物中含有共同的非氧元素,符合条件的有:
。氧化物(II)在氧气作用下生成氧化物(IV),说明这两种氧化物中含有共同的非氧元素,符合条件的有: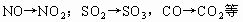 。氧化物(I)是氧化铁,联想到工业炼铁原理,不难想到氧化物(II)是CO,依次推断其他物质。符合上述条件的反应有:
。氧化物(I)是氧化铁,联想到工业炼铁原理,不难想到氧化物(II)是CO,依次推断其他物质。符合上述条件的反应有:
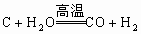 。
。
答案探究:因为教材中有乙醛、葡萄糖等含有�CHO的物质与新制氢氧化铜悬浊液反 导与解答。
导与解答。
(2)化学反应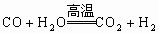 在讨论化学平衡问题时出现在教材里,而出现在其他处很少,部分考生不熟悉这个反应,导致无法解答全题;
在讨论化学平衡问题时出现在教材里,而出现在其他处很少,部分考生不熟悉这个反应,导致无法解答全题;
(3)碳在高温下与水蒸气反应制水煤气,仅在高中化学第一册第一章 的第三节出现过一次,但它是推断该题的关键,所以全面系统地复习、夯实基础是关键。
的第三节出现过一次,但它是推断该题的关键,所以全面系统地复习、夯实基础是关键。
例6:A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物。这些化合物和单质之间存在如下图所示的关系。
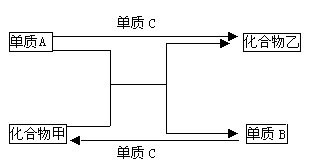
据此判断:
(1)在甲、乙两种化合物中,不含有组成A元素的化合物是_________,不含组成B元素的化合物是_______________(用“甲”、“乙”填写)。
(2)单质A是_____________(填“金属”、“非金属”或“既可以是金属又可以是非金属”)。
(3)若单质A是___________,则单质B、C分别是______________;若单质A是________,则单B、C分别是_____________;若单质A是___________,则单质B、C分别是________________。
解析:(1)从图中可发现下列反应关系:“单质B+单质C→化合物甲”,故甲中不含A元素;“单质A+单质C→化合物乙”,故乙中不含有B元素。
(2)从图示信息进行转换,可提炼出“单质A+ 化合物甲→单质B+化合 物乙”该反应属置换反应。置换反应有如下几种情况:
物乙”该反应属置换反应。置换反应有如下几种情况:
第一种情况:金属单质置换出金属单质。结合铝热反应可获得下列各种可能:(a)A为铝、B为铁、C为氧气等(铝与金属氧化物如四氧化三铁、三氧化二铁、氧化铜、二氧化锰、五氧化二钒等多种氧化物进行的反应,因而可得出多组答案。但由于题中限定了是短周期元素,可排除这些可能性)。
第二种情况:非金属单质置换出非金属单质。结合一些反应实例可获得答案(b)A、B、C依次为(下同)Cl2、S、H2;(c)O2、S、H2;(d)F2、O2、H2。(还可进一步分析:反应中单质表现了何种性质?总结出:氧化性A>B。)这样,就可进而获得更多答案(e)Cl2、Br2、H2;(f)Cl2、I2、H2;(g)Br2、I2、H2;(h)I2、S、H2;(I)C、H2、O2(制水煤气);(j)C、Si、O2(工业上制硅);(k)Br2、S、H2;(l)Cl2、N2、H2;(m)Si、H2、F2。
第三种情况:金属单质置换出非金属单质。(n)4)Mg、C、O2。
第四种情况:非金属单质置换出金属单质。(o)H2、Cu、O2;(p)H2、Fe、O2;(q)C、Cu、O2(由于铁、铜等不是短周期元素,所以不合题意)。
答案为:(1)甲;乙。
(2)单质A可以是金属也可以是非金属。
(3)可以有多组答案(见思路精析)。
从高考试题推理能力考查的特点分析,无机推断题命题主要表现了以下几个特点:
(1)单信息、多信息并重。同一道推断题中,有的结论只要分析单个信息就可以得出,有的结论需要同时综合多条信息才能得出。
(2)正向、逆向、综合三种形式的推理并重。有些结论的得出过程中,需要正向、逆向、综合等三种推理形式。
(3)定性、定量分析并重。推断过程中既需要定性分析、又需要定量分析。
(4)计算和逻辑推理并重。
(5)试题呈现开放性,答案不唯一。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com