
9.把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为
A.1︰2︰3 B.3︰2︰1 C.6︰3︰1 D.6︰3︰2
8.下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
7.pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH > a,则该电解质可能是
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
6.已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是
A.充电时作阳极,放电时作负极 B.充电时作阳极,放电时作正极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
5.钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A. 2H++2e-=H2 B. Fe2++2e-=Fe
B. 2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+
4.下列各变化中属于原电池反应的是
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更能氧化金属铜
3.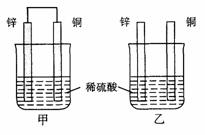 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
2. 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2
Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2
Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
1.废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是
A.锌 B.汞 C.石墨 D.二氧化锰
2. 金属的腐蚀
例6. 家用炒菜铁锅用水清洗放置后,常出现红棕色的锈斑,在此变化过程中不发生的化学反应是( )
A. 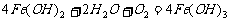
B. 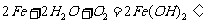
C. 
D. 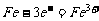
解析:洗过的铁锅在空气中放置,可发生吸氧腐蚀,负极发生的反应为: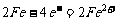 ,正极发生的反应为:
,正极发生的反应为: ,总反应式为:
,总反应式为: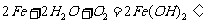 ,而
,而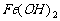 又易被O2氧化为红褐色的
又易被O2氧化为红褐色的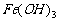 。答案:D
。答案:D
题型6、电子守恒法的应用。
例7、500 mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为1 mol·L-1 B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
解析:两极反应为:阴极 Cu2++2e-=Cu 2H++2e-=H2↑ 阳极:4OH--4e-=O2↑+2H2O,两极都收集1mol气体,由阳极得到转移电子为4mol,又知生成1molH2转移电子2mol,根据电子得失守恒,n(Cu2+)=1mol.再通过离子所带电荷的守恒,在500 mL KNO3和Cu(N03)2的混合溶液中存在关系:2c(Cu2+)+c(K+)=c(NO3-),可以求出c(K+)=2 mol·L-1 .电解过程中消耗的n(OH-)=4mol,则溶液中留下4mol的H+,c(H+)=8mol·L-1 .
答案:B
例8、如下图所示,若电解5min时铜电极质量增加2.16g,试回答:
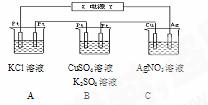
(1)电源电极X名称为_____________。
(2)pH变化:A___________, B__________, C__________。
(3)通电5min时,B中共收集224mL气体(标况),溶液体积为200mL。(设电解前后无体积变化)则通电前CuSO4溶液的物质的量浓度为__________。
(4)若A中KCl溶液的体积也是200mL,电解后,溶液的pH是___________(设前后体积无变化)。
 (4)A中阴极2H++2e-=H2↑,H+减少n(H+)=0.02mol,
(4)A中阴极2H++2e-=H2↑,H+减少n(H+)=0.02mol,
c(OH-) = 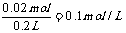 ,pH=13。
,pH=13。
答案:(1)负极(2)增大;减小;不变(3)0.025mol/L(4)13。
例9、(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼-空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
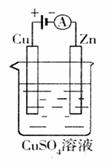 (3)下图是一个电化学过程示意图。
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼-空 气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况
气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况 下的空气
L(假设空气中氧气体积含量为20%)
下的空气
L(假设空气中氧气体积含量为20%)
解析:(1)注意32克N2H4为1mol,注意△H应与方程式的计量数相对应,如N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol
(2)肼-空气燃料电池,电解质溶液是KOH溶液。故电极反应为:
(正极)O2+2H2O+4e-=4OH- ,(负极)N2H4+4OH--4e-=4H2O+N2↑
(3)①此图为电解装置,铜片为阳极,锌片为阴极。锌片上发生的电极反应是Cu2++2e-=Cu
② 铜片减少128g,即转移电子4mol 根据O2+2H2O+4e-=4OH-计算得,需要氧气1mol,转化为空气则需要112L。
答案:(1)N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol
(2)O2+2H2O+4e-=4OH- ; N2H4+4OH--4e-=4H2O+ N2↑
N2↑
(3)①Cu2++2e-=Cu ②112
[专题测试]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com