
33.(8分)实验室常用的干燥剂“碱石灰”是CaO和NaOH固体的混合物。同学们为
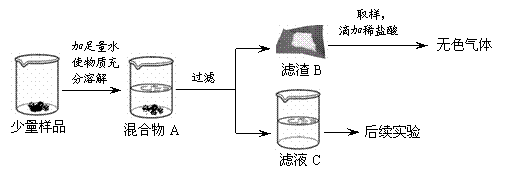 确认一瓶久置的“碱石灰”样品的成分,进行如下实验探究。
确认一瓶久置的“碱石灰”样品的成分,进行如下实验探究。
|
|||
|
 查阅资料:1.Ca(OH)2、Na2CO3溶于水无明显的温度变化。
查阅资料:1.Ca(OH)2、Na2CO3溶于水无明显的温度变化。
30.(12分)
(1)碱过量会使产物中有氢氧化铁生成,影响纯度;
(2)纸上层析;Fe3++3NH3·H2O=Fe(OH)3↓+3NH44;
Cu2++4NH3·H2O=Cu(NH3)42++4H2O
(3)洗涤除去晶体表面附着的Na2H2EDTA、氯化物等杂质,用冰水洗涤可降低洗涤过程中NaFeEDTA· 3H2O的损耗,用酒精洗涤可使其快速干燥。
(4)步骤④中溶剂蒸发速度快,步骤⑤冷却速率快。
(5)NH4SCN
(6)78. 9%
30、(12分)铁强化酱油是在酱油添加食品强化剂--乙二胺四乙酸铁钠盐,乙二胺四乙酸铁钠盐化学式为:C10Hl2FeN2NaO8·3H2O,式量:421,EDTA铁钠盐呈浅土黄色结晶粉末,性稳定,易溶于水及难溶于乙醇。l%的水溶液pH约为3.5,可由乙二胺四乙酸一钠盐(NaH3EDTA)与氯化铁制取,制取原理如下:
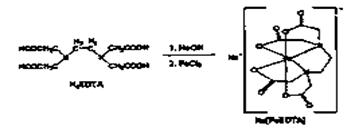
实验室制备NaFeEDTA·3H2O步骤如下:
①把0.4g(0.0lmo|)NaOH溶于l0mL蒸馏水,然后再加入3.8g(0.01mo1)Na2H2EDTA·2H2O,把溶液微热,直至固体完全溶解。
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3·6H2O。称取2.5g(0.009mol)FeCl3·6H2O溶予5mL,蒸馏水中(并加l滴盐酸)。
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出。
⑤冷却、采用右图装置减压过滤,先用冰水洗涤樗用乙醇洗涤。
⑥将固体凉干,称得制得的淡黄色粉末2.8g
试回答下列问题
(1)在步骤①中,须加入过量的碱,是因为 。
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是 ;加显色利后分别发生反应的离子方程式为 ; 。
(3)步骤⑤中用冰水和乙醇洗涤的目的是, , 。
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是: 。
(5)检验某品牌酱油中是否加有NaFeEDTA·3H2O,先取20mL酱油加入10rnL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是 (写化学式)。
(6)本次实验的NaFeEDTA·3H2O的实际产率为: 。
29、(1)三颈烧瓶 防暴沸 (2)AC (3)可减少产品的损失
(4)拆下连接泵和吸滤瓶的橡皮管 关闭水龙头 (5)提高产品的纯度
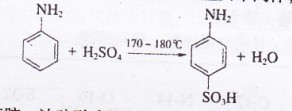
29、(12分)对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:
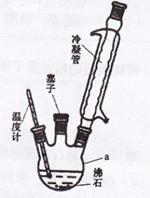
实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成。
实验步骤如下:
①取一个250mL的仪器a,加入10mL苯胺及几粒沸石,
放人冷水中冷却,小心地加入18 mL浓硫酸。再分别
装上冷凝管、温度计等。
②将a置于油浴中缓慢加热至170`180℃,维持此温度约2.5 h。
③将反应产物冷却至约50℃后,倒入盛有100 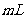 ,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集
产品,晾干。(提示:100mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可
溶解6.67 g)
(1)仪器a的名称是 。步骤①中加入沸石的作用是 。
(2)步骤②中采用油浴加热,下列说法正确的是 。(填字母)
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是 。
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先一二,然
后 。
(5)步骤④有时需重复进行多次,其目的是 。
28、⑴防止酸雨的发生 ⑵①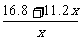 ②-724.5kJ·mol-1
②-724.5kJ·mol-1
⑶①6NO+3O2+2C2H4
 3N2+4CO2+4H2O ②350℃、负载率3%(共10分)
3N2+4CO2+4H2O ②350℃、负载率3%(共10分)
28、(10分)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
⑴烟气脱硫、脱硝的环境意义是 。
⑵选择性催化还原法的脱硝原理为:
6NOx+4x NH3
 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为 L。
②已知:2H2(g)+O2(g) =2H2O (g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH= 。
⑶目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
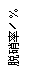
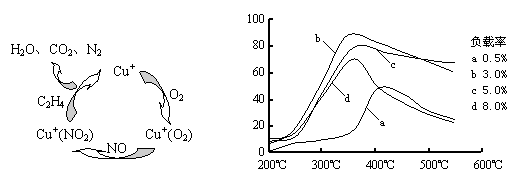

图1 图2
①写出该脱硝原理总反应的化学方程式: 。
②为达到最佳脱硝效果,应采取的条件是 。
27.(6分)
(1)C6H5NO3·1.5H2O的相对分子质量是166,166的16.27%刚好是1.5个H2O的质量,说明从变色开始到完全变色是因为该晶体失去全部结晶水,从而变色后的化学式为C6H5NO3(2分)
(2)具有可逆热色性的原因是:晶体加热到某一温度推动结晶水,晶体结构发生变化;温度降低,晶体又可以吸收空气中的水分而使晶体结构复原,从而颜色复原。(2分)
(3)验证实验:把加热变色后的晶体放入实验室的干燥器中,会发现在温度降低后颜色不能复原,而拿到空气下晶体颜色很快就能复原,说明吸收了
|
27、(6分)南京师大结构化学实验室最近设计合成了一种黄色对硝基苯酚水合物多功能晶体材料:C6H5NO3·1.5H2O。实验表明,加热至94℃时该晶体能由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,即具有可逆热色性。热分析试验表明,当温度升高到94℃时该晶体开始失重,到131℃重量不再变化,比原来轻了16.27%。
(1)试给出该晶体完全变红色后的化学式
(2)据此分析该晶体具有可逆热色性的原因
(3)设计一个简单的实验来验证这种分析 。
26、(1)(胶头)滴管 (2)常温下铁在浓硝酸中钝化 (3)溶液变成血红色
(3Fe2+ + 4H+ + NO3- = 3Fe3+ + NO↑ + 2H2O)Fe3+ + 3SCN- = Fe(SCN)3(前面括号内的反应不答不扣分)(4)管口塞蘸有碱液的棉花团
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com