
28.(16分)阻垢剂可防止工业用水过程中无机物沉积结垢,经由下列反应路线可得到E和R两种阻垢剂(部分反应条件略去).
(1)阻垢剂E的制备
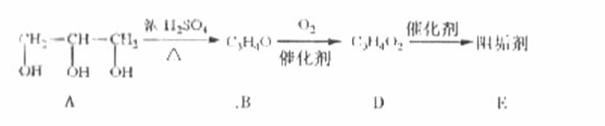
① A可由人类重要的营养物质________水解制得(填“糖类”、“油脂”或“蛋白质”).
② B与新制的Cu(OH)2反应生成D,其化学方程式为______________.
③ D经加聚反应生成E,E的结构简式为______________.
(2)阻垢剂R的制备

① 为取代反应,J的结构简式为__________________.
为取代反应,J的结构简式为__________________.
②J转化为L的过程中,L分子中增加的碳原子来源于 __________________.
③由L制备M的反应步骤依次为:

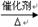
 、_____、_____(用化学方程式表示).
、_____、_____(用化学方程式表示).
④1 mol Q的同分异构体T(碳链无支链)与足量NaHCO3溶液作用产生2 mol CO2,T的结构简式为__________(只写一种).
28.答案(16分)
(1)①油脂
②
③

(2) ①CH2BrCH2Br ②CO2
③HOOCCH2CHBrCOOH+3NaOH NaOOCCH=CHOONa+NaBr+3H2O
NaOOCCH=CHOONa+NaBr+3H2O
NaOOCCH=CHCOONa+H2SO4→HOOCCH==CHCOOH+Na2SO.
④

[解析]本题考查有机物的推断。(1)油脂水解可得高级脂肪酸和甘油(物质A)。B能与新制的Cu(OH)2反应,说明B中含有醛基。由B的化学式可知,B的结构简式为CH2=CHCHO。再经催化氧化可得D为CH2=CHCOOH。再将碳碳双键打开,发生加聚反应即可得E。(2)G至J是将溴取代了羟基。由J至L的条件不难发现,增加的碳应为CO2中的碳。L至M即是要产生碳碳双键。溴原子在碱的醇溶液中发生消去反应,可得碳碳双键,生成的钠盐在H2SO4作用下,发生强酸制弱酸,即可得M。1mol Q与NaHCO3能产生2mol CO2,则Q中应存在2个羧基,而Q中的环,可以改成双键(碳氧双键或是碳碳双键均可)。
27.(15分)某兴趣小组用题27图装置探究氨的催化氧化.
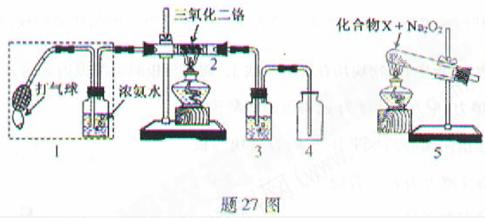
(1)氨催化氧化的化学方程式为___________________.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”).
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________.
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________.
27.答案(15分)
(1)4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)放热
(3)浓H2SO4;生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了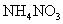
(4)I; 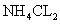 与HCL反应生成氧气(合理答案均给分)
与HCL反应生成氧气(合理答案均给分)
[解析]本题考查氨的催化氧化。(1)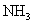 和
和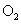 氧化生成
氧化生成 。(2)该反应为放热,故不加热后仍能保持红热状态。(3)产物中有
。(2)该反应为放热,故不加热后仍能保持红热状态。(3)产物中有 和
和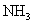 ,
, 会被
会被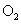 氧化生成
氧化生成 ,在于空气中的水蒸气反应生成
,在于空气中的水蒸气反应生成 ,而
,而 与
与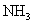 会产生白烟。(4)装置5与1均产生科产生
会产生白烟。(4)装置5与1均产生科产生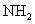 。
。 加热分解可得
加热分解可得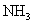 和HCL,而HCL与
和HCL,而HCL与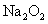 可生成
可生成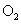 。
。
26.答案(5分)
(1)第四周期第ⅡA族,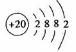
(2) 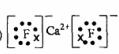 ,高
,高
(3)2P+5FeO+3CaO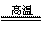 Ca3(PO4)2+5Fe
Ca3(PO4)2+5Fe
(4)Fe;Fe+3SCN-=Fe(SCN)3
(5)1.1
[解析]本题考查钙、铁的知识。(1)Ca为20号,位于第四周期,第IIA族。(2)最活泼的金属为:F,  为离子化合物,
为离子化合物, 为分子晶体,故
为分子晶体,故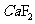 的沸点高。(3)P从0价升至+5价,
的沸点高。(3)P从0价升至+5价, 从+2价降至0价,根据得失电子守恒有,P前配2,
从+2价降至0价,根据得失电子守恒有,P前配2, 前配5.(4)有颜色变化可知,红褐色
前配5.(4)有颜色变化可知,红褐色 为
为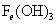 ,
,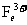 与KSCN变血红色。(5)
与KSCN变血红色。(5) 与
与 中只有
中只有 与水能反应生成
与水能反应生成 ,由
,由 ~
~ 得,n(
得,n( )=0.224/22.4=0.01mol。n(
)=0.224/22.4=0.01mol。n(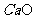 )=1.6×3.5%/56=0.01MOL。由钙守恒得,m(
)=1.6×3.5%/56=0.01MOL。由钙守恒得,m( )=(0.01+0.001)×100=1.1g。
)=(0.01+0.001)×100=1.1g。
26.(15分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数)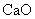 .
.
(1) 元素在周期表中位置是
,其原子结构示意图
.
元素在周期表中位置是
,其原子结构示意图
.
(2) 与最活跃的非金属元素A形成化合物D,D的电子式为
,D的沸点比A与
与最活跃的非金属元素A形成化合物D,D的电子式为
,D的沸点比A与 形成的化合物E的沸点
.
形成的化合物E的沸点
.
(3)配平用钙线氧脱鳞的化学方程式:
P+ FeO+ CaO
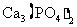 + Fe
+ Fe
(4)将钙线试样溶于稀盐酸后,加入过量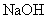 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色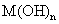 .则金属M为______;检测
.则金属M为______;检测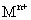 的方法是_____(用离子方程式表达).
的方法是_____(用离子方程式表达).
(5)取1.6g钙线试样,与水充分反映,生成224ml. (标准状况),在想溶液中通入适量的
(标准状况),在想溶液中通入适量的 ,最多能得到
,最多能得到 g.
g.
12. 答案D
[解析]本题考查盖斯定律的计算。由已知得:Br2(l)=Br2(g) DH=+30KJ/mol,则H2(g) + Br2(g) = 2HBr(g);DH= -102KJ/mol。436+a-2×369=-102;a=―200KJ,D项正确。
12.已知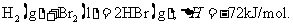 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:

则表中a为
A.404 B.260 C.230 D.200
11. 答案B
[解析]本题考查有机物的结构与性质。A项,扑热息痛含有酚烃基,而阿司匹林没有,而酚烃基可以与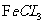 可发生显色反应,正确。B项,阿司匹林中酯水解生成的酚还要继续与
可发生显色反应,正确。B项,阿司匹林中酯水解生成的酚还要继续与 反应,故1mol阿司匹林可消耗3mol
反应,故1mol阿司匹林可消耗3mol ,错误。C项,贝诺酯中有两个酯基,这些均为憎水基,故其溶解度小,正确。D项,扑热息痛的水解产物之一为:
,错误。C项,贝诺酯中有两个酯基,这些均为憎水基,故其溶解度小,正确。D项,扑热息痛的水解产物之一为: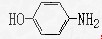 ,其化学式为
,其化学式为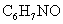 ,正确。
,正确。
11.贝诺酯是由阿司匹林、扑热息痛经化学法拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下:
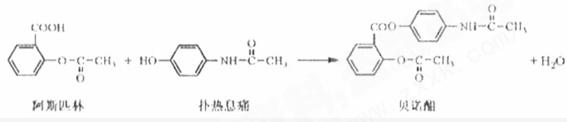
下列叙述错误的是
A.FeCl3 溶液可区别阿司匹林和扑热息痛
B.1mol阿司匹林最多可消耗2mol NaOH
C.常温下贝诺酯在水中的溶解度小于扑热息痛
D.C6H7NO 是扑热息痛发生类似脂水解反应的产物
10. 答案B
[解析]本题考查化学平衡的移动。该反应为体积增大的吸热反应,所以升温和减压均可以促使反应正向移动。恒压通入惰性气体,相当于减压。恒容通入惰性气体与加催化剂均对平衡无影响。增加CO的浓度,将导致平衡逆向移动。
[方法提炼]对于恒容容器,通入稀有气体,由于容器的体积不变,各组分的浓度保持不变,故反应速率保持不变,平衡也即不移动。若为恒压容器,通入稀有气体,容器的体积膨胀,对于反应则相当于减压。
10.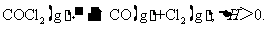 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度
④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度
④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com