
8.Mg、Zn等较活泼金属溶于强酸弱碱盐(如NH4Cl、AlCl3、FeCl3等)溶液中,能产生H2。例如:将镁条投入NH4Cl溶液中,有H2、NH3产生,有关离子方程式为:NH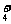 +H2O
+H2O NH3·H2O+H+,Mg+2H+===Mg2++H2↑。
NH3·H2O+H+,Mg+2H+===Mg2++H2↑。
7.用盐(铁盐、铝盐)作净水剂时需考虑盐类水解。例如,明矾[KAl(SO4)2·12H2O]净水原理:Al3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3胶体表面积大,吸附能力强,能吸附水中悬浮物生成沉淀而起到净水作用。
Al(OH)3(胶体)+3H+,Al(OH)3胶体表面积大,吸附能力强,能吸附水中悬浮物生成沉淀而起到净水作用。
6.若一种盐的酸根和另一种盐的阳离子能发生水解相互促进反应,这两种盐相遇时,要考虑它们水解的相互促进,如泡沫灭火器原理:利用硫酸铝溶液和碳酸氢钠溶液混合,Al2(SO4)3+6NaHCO3===3Na2SO4+2Al(OH)3↓+6CO2↑,产生大量CO2来灭火。
5.配制易水解的盐溶液时,需考虑抑制盐的水解
(1)配制强酸弱碱盐溶液时,滴加少量相应的强酸,可抑制弱碱阳离子的水解,如配制FeCl3、AlCl3溶液时滴几滴稀盐酸,配制Fe2(SO4)3溶液时,滴几滴稀硫酸。
(2)配制强碱弱酸盐溶液时,滴加少量相应的强碱,可抑制弱酸根离子的水解,如配制Na2CO3、K2S溶液时滴几滴NaOH溶液。
4.某些试剂的实验室贮存要考虑盐的水解
例如:Na2CO3、NaHCO3溶液因CO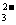 、HCO
、HCO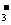 水解使溶液呈碱性,OH-与玻璃中的SiO2反应生成硅酸盐,使试剂瓶颈与瓶塞黏结,因而不能用带玻璃塞的试剂瓶贮存,必须用带橡皮塞的试剂瓶贮存。
水解使溶液呈碱性,OH-与玻璃中的SiO2反应生成硅酸盐,使试剂瓶颈与瓶塞黏结,因而不能用带玻璃塞的试剂瓶贮存,必须用带橡皮塞的试剂瓶贮存。
3.无水盐制备
(1)制备挥发性强酸弱碱盐,如FeCl3,从溶液中得晶体时,必须在HCl氛围下失去结晶水,否则易得Fe(OH)3或Fe2O3。
(2)难挥发性强酸弱碱盐可直接加热得无水盐,如Al2(SO4)3。
2.判断盐溶液中离子种类及其浓度大小顺序
如Na2S溶液中,Na2S===2Na++S2-
S2-+H2O HS-+OH-
HS-+OH-
HS-+H2O H2S+OH-
H2S+OH-
H2O H++OH-
H++OH-
所以溶液中存在的微粒有:Na+、S2-、HS-、H2S、H+、OH-、H2O,且c(Na+)>2c(S2-),c(OH-)>c(H+)。
1.判断盐溶液的酸碱性
(1)强酸弱碱盐水解,pH小于7,如NH4Cl、CuSO4、FeCl3、Zn(NO3)2等。
(2)强碱弱酸盐水解,pH大于7,如CH3COONa、K2CO3、NaHCO3、Na2S等。
(3)强酸强碱盐不水解,溶液呈中性,如NaCl、K2SO4等。
(4)弱酸酸式盐溶液的酸碱性,取决于酸根离子的电离程度和水解程度的相对大小。
2.几种题型
(1)多元弱酸溶液中,根据弱酸的分步电离进行分析,如在H3PO4溶液中:
c(H+)>c(H2PO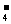 )>c(HPO
)>c(HPO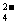 )>c(PO
)>c(PO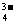 )。
)。
(2)多元弱酸的正盐溶液中,按弱酸根离子的分步水解进行分析:如在Na2CO3溶液中:
c(Na+)>c(CO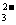 )>c(OH-)>c(HCO
)>c(OH-)>c(HCO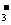 )。
)。
(3)不同溶液中同一离子浓度大小的比较,要看溶液中其他离子对该离子的影响,如在同物质的量浓度的下列溶液中:NH4Cl;②CH3COONH4;③NH4HSO4,c(NH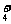 )由大到小的顺亭为:③>①>②。
)由大到小的顺亭为:③>①>②。
(4)混合溶液中各离子浓度的比较,要进行综合分析,如电离因素、水解因素等。如在0.1 mol·L-1 NHCl溶液和0.1 mol·L-1的氨水混合溶液中,各离子浓度大小的顺序为:c(NH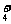 )>c(Cl-)>c(OH-)>c(H+)。
)>c(Cl-)>c(OH-)>c(H+)。
考点八、盐类水解的应用
1.几个依据
(1)电离理论
发生电离粒子的浓度大于电离生成粒子的浓度,如H2CO3溶液中: c(H2CO3)>c(HCO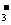 )》c(CO
)》c(CO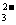 )(多元弱酸第一步电离程度远远大于第二步电离)
)(多元弱酸第一步电离程度远远大于第二步电离)
(2)水解理论
发生水解离子的浓度大于水解生成粒子的浓度,如Na2CO3溶液中: c(CO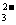 )>c(HCO
)>c(HCO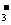 )》c(H2CO3)(多元弱酸酸根离子的水解以第一步为主)
)》c(H2CO3)(多元弱酸酸根离子的水解以第一步为主)
(3) 电解质溶液中的守恒关系
|
守恒关系 |
定义 |
实例 |
|
电荷守恒 |
电解质溶液呈电中性,即所有阳离子所带的正电荷总数与所有阴离子所带的负电荷总数相等 |
例如在NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
|
物料守恒 |
实质也就是原子守恒,即原子在变化过程(水解、电离)中数目不变 |
例如在Na2CO3溶液中:1/2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
|
质子守恒 |
即在纯水中加入电解质,最后溶液中由水电离出的H+与OH-离子守恒(可由电荷守恒及物料守恒推出) |
例如在Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com