
5.下列关于细胞核的叙述正确的是
A.真核细胞的核膜上有大量的多种酶,有利于多种化学反应的顺利进行
B.细胞核是遗传信息库,也是细胞代谢的中心
C.真核细胞的核膜上有核孔,是脱氧核糖核酸等大分子物质的通道
D.原核细胞的拟核除无核膜外,其他方面与真核细胞的细胞核没有差别
4. 右图为电子显微镜视野中观察的某细胞的一部分。下列有关该细胞的叙述中,正确的是
右图为电子显微镜视野中观察的某细胞的一部分。下列有关该细胞的叙述中,正确的是
A.此细胞是真核细胞也可能是原核细胞
B.此细胞是动物细胞而也可能是植物细胞
C.结构1、3、5中都能发生DNA复制和表达
D.结构4含磷脂,是细胞内脂质的合成“车间”
3.豌豆的种子有圆粒的和皱粒的。圆粒种子含淀粉多,成熟时能有效地保留水分。而皱粒种子含蔗糖多,在成熟时由于失水而皱缩。上述圆粒种子保留的水分和皱粒种子失去的水分
A.前者主要是结合水,后者是自由水 B.两者都主要是结合水
C.前者主要是自由水,后者是结合水 D.两者都是自由水
2.下列关于组成细胞化合物的叙述,正确的是
A.蛋白质肽链的盘曲和折叠被解开时,其特定功能并未发生改变
B.胆固醇是构成细胞膜的重要成分之一
C.蔗糖和麦芽糖水解的产物都是葡萄糖
D.脂肪和纤维素是生物体内的能源物质
1.以下关于实验的描述,正确的是
A.利用光学显微镜可观察到细胞膜的磷脂双分子层
B.西瓜汁中含有丰富的葡萄糖和果糖,可用作还原糖鉴定的替代材料
C.观察洋葱根尖的有丝分裂必须保持材料的生物活性
D.在稀豆浆溶液中加入双缩脲试剂,振荡摇匀,可看到溶液变为紫色
25.(5分)在25℃下,将c mol·L-1的CH3COOH溶液与0.01 mol·L-1的NaOH溶液等体积混合,反应后溶液中存在c(CH3COO-)=c(Na+)。则反应后的溶液显 ▲ 性(填“酸”、“碱”或“中”);用含c 的代数式表示CH3COOH的电离常数Ka= ▲ 。

|
实验编号 |
T/℃[ |
NO初始浓度/mol·L-1 |
CO初始浓度/mol·L-1 |
催化剂的比表面积/m2·g-1 |
|
Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
Ⅱ |
▲ |
▲ |
▲ |
124 |
|
Ⅲ |
350 |
▲ |
▲ |
124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。
24.(14分)某学习小组用右图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
⑴、A中试剂为______________▲_______________。
⑵、实验前,先将铝镁合金在稀硝酸中浸泡片刻,其目的是______________▲________。
⑶、检查气密性,将药品和水装入各仪器中,连接好装置后,
需进行的操作还有:①记录C的液面位置;②将B中剩余固
体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢
复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是______________▲_______________(填序号);记录C的液面位置时,除视线平视外,还应____ ▲ _ 。
⑷、B中发生反应的化学方程式为_____________▲_________;
⑸、若实验用铝镁合金的质量为a g ,测得氢气体积为b mL (已换算为标准状况),B中剩余固体质量为c g,则铝的相对原子质量为_____▲_______。
⑹、实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将______▲_____(填“偏大”、“偏小”、“不受影响”)。
23.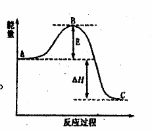 (10分)H2O2是重要的氧化剂,还原剂,它的水
(10分)H2O2是重要的氧化剂,还原剂,它的水 溶液常用来消毒、杀菌、漂白等。
溶液常用来消毒、杀菌、漂白等。
请回答下列有关问题。
(1)2H2O2(l)=2H2O(l)+O2(g)反应过程中的能量变化如图所示。
已知1 mol H2O2分解为1 mol H2O的△H= -98.23 kJ·mol-1
该反应常用MnO2作催化剂,则加入MnO2会使图中B点 ▲
(填“升高”、“降低”),图中△H= ▲ 。
(2)H2O2和H2O都是极弱电解质;水电离生成H3O+和OH-
即:H2O+H2O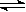 H3O++OH-叫做水自偶电离;H2O2也有极微弱的自偶电离,
H3O++OH-叫做水自偶电离;H2O2也有极微弱的自偶电离,
其自偶电离的方程式为 ▲
(3)某化学兴趣小组用酸化KMnO4标准溶液滴定H2O2溶液样品,测定H2O2溶液中H2O2的含量。请配平其反应的离子方程式为:
 ▲ H2O2+ ▲ MnO4-+
▲ H+=
▲ Mn2++ ▲ O2↑+ ▲
H2O
▲ H2O2+ ▲ MnO4-+
▲ H+=
▲ Mn2++ ▲ O2↑+ ▲
H2O
①酸性KMnO4溶液不能放在碱式滴定管中,原因是 ▲
②用KMnO4溶液滴定H2O2样品,终点时溶液颜色变化为 ▲
③滴定时,若滴定管中滴定液下降到活塞处才达到滴定终点,则能否由此得出准确的测定结果,原因是什么? ▲
22. (12分)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(12分)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 ▲ 。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为 ▲
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2 反应,其产物之一是Y的单质,Y的单质的电子式为 ▲ ;
反应,其产物之一是Y的单质,Y的单质的电子式为 ▲ ;
Z分子的结构呈 ▲ ②A的化学式是 ▲
(4)X的单质、石墨和二氧化钛TiO-2按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭河导弹上有重要应用),其反应的化学方程式是
▲
21.(11分)设反应①Fe(s)+CO2(g)
 FeO(s)+CO(g) 平衡常数为K1
FeO(s)+CO(g) 平衡常数为K1
反应②Fe(s)+H2O(g)  FeO(s)+H2(g) 平衡常数为K2
FeO(s)+H2(g) 平衡常数为K2
测得在不同温度下,K1、K2值如下:
|
温度/℃ |
K1 |
K2 |
|
500 |
1.00 |
3.15 |
|
700 |
1.47 |
2.26 |
|
900 |
2.40 |
1.60 |
(1)若500℃时进行反应①,CO2起始浓度为2mol.L-1,CO2转化率为____ ▲ _____
(2)反应②在常温下为 ▲ 反应 (填“自发或非自发”)。请简述理由
▲
(3)700℃反应②达到平衡,使得该平衡向右移动,其它条件不变时,可以采取的措施有
_ ▲ (填序号)
A、缩小反应器体积 B、加入水蒸气 C、升高温度到900℃ D、使用合适的催化剂
(4)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度 ▲ ;
②再通入CO2,CO2的转化率  ▲
。
▲
。
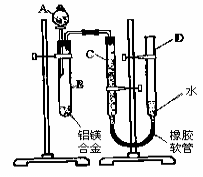
(5)下列图像符合反应①的是 ▲ (填序号)(图中v是速率、φ为混合气体CO含量,T为温度)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com