
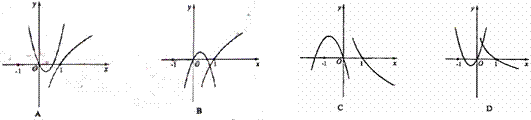
6.函数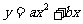 与
与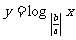 (
(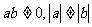 |)在同一直角坐标系中的图像可能是
|)在同一直角坐标系中的图像可能是
( )
5.函数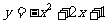 与y=1相交形成一个封闭图形,则该封闭图形的面积是( )
与y=1相交形成一个封闭图形,则该封闭图形的面积是( )
A.1 B. C. D.2
4.已知函数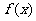 是定义在R上的奇函数,其最小正周期为3, 且
是定义在R上的奇函数,其最小正周期为3, 且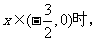
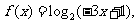 则
则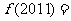 ( )
( )
A.4 B.2 C.
-2 D.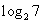
3.函数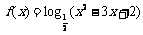 的值域是 ( )
的值域是 ( )
A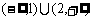 B(1,2) C.R D[2,
B(1,2) C.R D[2,
2.下列4个命题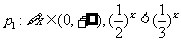 ,
,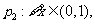
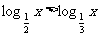
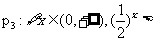
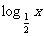 ,
,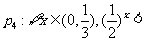
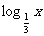
其中的真命题是 ( )
A. 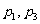 B.
B.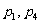 C.
C.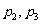 D.
D.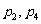
1.已知全集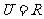 ,集合
,集合 和
和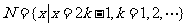 的关系的韦恩(Venn)图如图1所示,则阴影部分所示的集合的元素共有 ( )
的关系的韦恩(Venn)图如图1所示,则阴影部分所示的集合的元素共有 ( )
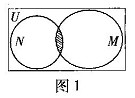 A.3个
A.3个
B.2个
C.1个
D.无穷多个
23.(14分)某校化学兴趣小组在探究“卤素单质的氧化性”的实验中发现:在足量的稀氯化亚铁溶液中加入少量碘水,振荡后溶液呈黄色。
(1)提出问题:Fe3+和I2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性I2>Fe3+,则溶液呈黄色是含__________________所致。
②乙同学认为氧化性Fe3+>I2,则溶液呈黄色是含__________________所致。
(3)设计实验并验证:
为了验证乙同学的观点,丙同学选用下列某些试剂设计方案并实验,通过观察实验现象,证明了乙同学的观点的确是正确的。
可供选择的试剂:
a.紫色石蕊试液 b.淀粉溶液 c.苯 d.硫化钾溶液 e.无水酒精 f.苯酚稀溶液
请在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号,表格可不填满)
|
所选试剂 |
|
|
|
|
|
|
实验现象 |
|
|
|
|
|
(4)应用与拓展
①若将SO2气体通入碘水中,溶液黄色逐渐消失,则Fe2+、I-、SO2三种粒子的还原性由强到弱的顺序是__________________________________
②若将SO2气体通入FeCl3溶液中,能否发生反应?如果不能反应,请说出理由;如果能反应,请写出反应的离子方程式:
______________________________________________________________________
③在100mL的碘化亚铁溶液中通入4.48L Cl2(标准状况),溶液中有2/3的Fe2+被氧化,则原碘化亚铁溶液中FeI2的物质的量浓度为_________________________
22.(10分)X、Y、Z、W、V为前四周期常见的五种元素,其中有四种为短周期元素,其相关信息如下表:
|
元素 |
相 关 信 息 |
|
X |
X原子核外电子数等于电子层数 |
|
Y |
常温常压下,Y单质固体难溶于水而易溶于CS2 |
|
Z |
Z基态原子的次外层为18个电子,最外层无成对电子 |
|
W |
W的氢化物在水中可完全电离出氢离子 |
|
V |
V原子的电子层数是其价电子数的三倍 |
请回答下列问题:
(1)写出实验室通过加热制备W单质的离子方程式
_______________________________________________________________________
(2)V的两种常见氧化物中阳离子和阴离子个数比为2:1的是:
__________________________________(写化学式)
(3)写出Y单质和Z单质反应的化学方程式
_______________________________________________________________________
(4)写出X、Y、V三种元素组成的化合物的水溶液与W单质反应的离子方程式
_____________________________________________________________________
(5)10g Z单质和500mL 1.2mol/L稀硝酸在一定条件下反应,硝酸被还原仅生成一种无毒的气体,Z单质完全溶解。向反应后的溶液中再加入50mL 2.4mol/L的稀硫酸,则所得溶液还能溶解Z单质的质量是_________g。(假定反应条件不变)
21.(11分)某课外活动小组在实验室制备氨气,并进行有关氨气的性质探究。
实验室中可供选择的药品有:
A.生石灰、 B.浓氨水、C.NaOH固体、D.氯化铵、E.硝酸铵
(1)该小组在上述药品中只选择两种合适的试剂制备干燥的氨气。
①应该选用的仪器及装置有(填字母) 。

|
|
|
|
|
|
|
|
|
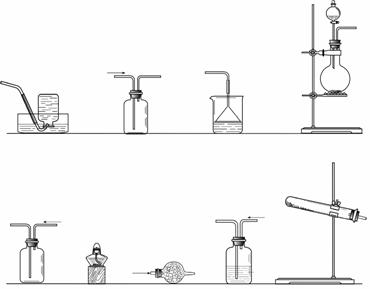
②所选择的试剂能产生氨气的原因是____________________________________
____________________________________________ 。
(2)该小组同学设计下图所示装置探究氨气的还原性。
|
|
|
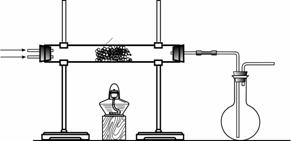
①氨催化氧化的化学方程式为 _____ 。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 ___________ 。
(3)该小组同学以氨气和二氧化碳为原料制备高浓度的碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。你认为哪一位同学的方案合理并说明原因。
②检验产物中有NH4+的方法为 。
20.(13分)锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
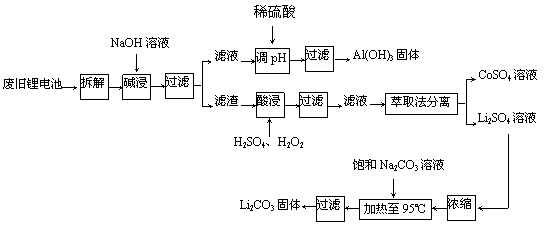
(1)上述工艺回收到的产物有 _______________________ 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全,对拆解环境的要求是____________________________________________________________________。
(3)碱浸时主要反应的离子方程式为__________________________________________。
(4)酸浸时反应的化学方程式为______________________________________________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是______________________________________________________________________。
(5)生成Li2CO3的化学反应方程式为__________________________________________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com