
20.(6分)有不同的短周期元素X、Y。X的单质既可与盐酸反应,又可与NaOH溶液反应,Y的一种单质常做电极材料。
(1)X的单质、Y的单质和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是
(2)在298K下,Y、X的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,X的单质能将Y从它的最高价氧化物中置换出来,若此置换反应生成3molY的单质,则该反应在298K下的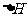 =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
19.(18分)Ⅰ.(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸 ④稀硝酸,能随即发生剧烈反应的是(填序号,下同) ,常温下缓慢反应(或微热后能发生剧烈反应)的是 ,常温下不反应,但加热后发生剧烈反应的是 ,加热也不发生反应的是 。由此可以得到上述四种酸氧化性由强到弱的顺序是: 。
(2)工业上用洗净的废铜屑作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是 (填序号)
A.Cu + HNO3(浓)Cu(NO3)2 B.Cu + HNO3(稀)Cu(NO3)2
C.Cu空气△ CuO浓硝酸 Cu(NO3)2 D.Cu浓硫酸△ CuSO4Ba(NO3 Cu(NO3)2
(3)先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括
 A.通入X气体后产生白色沉淀
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是:
A.HNO3的酸性比H2SO4强 B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸 D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
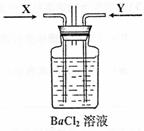
Ⅱ.下图是用过量的铜与40mL稀硝酸在100mL烧瓶中反应制取一氧化氮气体的实验装置图,请回答下列问题:
(1)请在右框中画出气体收集装置的装置图。
(2)反应刚开始时的现象是__________________________________________________,
反应停止时的现象是_________________________________________________,
18.(16分)某工厂有废合金(含有铝、铁、铜)粉末,甲同学探索工业废料的利用,用该废合金粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如下:
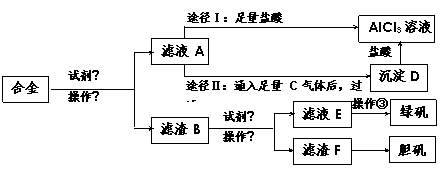
试回答下列问题:
(1)所加试剂①、②分别是 、 。
(2)操作①的名称为 ,所用的仪器除铁架台、铁圈和烧杯,还需要的器材有 。
(3)由滤液A制AlCl3溶液有途径Ⅰ和途径Ⅱ两种,你认为合理的是___________,理由是____________________________________________________________;
(4)写出A→D反应离子方程式:__________________________________________。
(5)操作③的名称是_________________。
17.(18分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为______________________(用元素符号表示)。
(2)①、②、④、⑤中的四种元素形成的某无机盐的用途是(举出一例即可) ;由这四种元素形成的某盐的式量为82,该盐的水溶液呈_______性,理由是(用离子方程式解释)______ 。
(3)由表中④、⑤两种元素的原子按1:1组成的化合物中含有化学键类型为______________,
由1mol该化合物与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 。
A.NaOH Na2CO3 B.Na2CO3 C.Na2O2 Na2CO3 D.Na2O2 NaOH Na2CO3
(4)⑧的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式:______________________ 。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
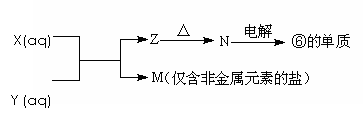
X溶液与Y溶液反应的离子方程式为_____________________,常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至____________(填酸性、碱性或中性)。
16.往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(标准状况下)时立即停止,则在这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)
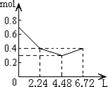
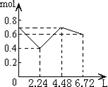
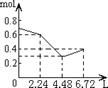
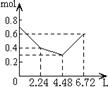
A B C D
15.将一定体积稀硝酸溶液平均分成两份,一份与足量的铜粉反应收集到气体的体积为Vl;另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到气体的体积为V2(Vl和V2都在同一条件下 测定),已知V2=3Vl,则稀硝酸和稀硫酸的物质的量浓度之比为
A.1:1 B.l:2 C.1:3 D.无法确定 .
14.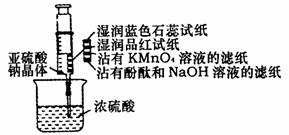 如右图所示,在注射器中加入少量Na2SO3晶体,并吸入少量的硫酸(以不接触纸条为准)。则下列有关说法正确的是
如右图所示,在注射器中加入少量Na2SO3晶体,并吸入少量的硫酸(以不接触纸条为准)。则下列有关说法正确的是
A.蓝色石蕊试纸先变红后褪色
B.沾有KMnO4溶液的滤纸褪色,证明了
SO2的漂白性
C.品红试纸褪色,证明了SO2的漂白性
D.沾有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性
13.某无色溶液中只可能含有①Na+ 、②Ba2 +、 ③Cl一、 ④Br一、⑤SO32一、⑥SO42一 离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
|
下列结论正确的是
A.肯定含有的离子是③④⑤ B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥ D.不能确定的离子是③⑥
12.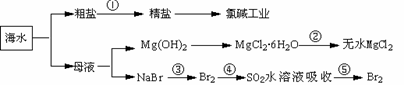 海洋中有丰富的食品、矿产,能源、药物和水产资源等(如下图所示),
海洋中有丰富的食品、矿产,能源、药物和水产资源等(如下图所示),
下列有关说法正确的是
A.大量的氰、磷废水排入海洋,易引发赤潮
B.第②步中结晶出的MgCl2·6H20可在空气中受热分解制无水MgCl2
C.在第③④⑤步中溴元素均被氧化
D.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
11.下列事实得出的结论正确的是
A.用一束强光照射经过煮沸的三氯化铁溶液有光的通路,说明已生成氢氧化铁胶体
B.某雨水样品放置一段时间,pH由5.6变为4.3,说明水中溶解了更多的CO
C.常温下铜可溶于浓硝酸,铁不溶于浓硝酸,说明铜比铁更活泼
D.二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com