
25.(江苏省连云港市2007年三模试卷)含有NO3-的废水会造成水污染,金属镁可将废水中的NO3-还原为N2,且反应后溶液的pH>7,从而消除NO3-的污染。已知含0.002mol/L NO3-的废水100mL与0.012g镁粉恰好完全反应。
(1)写出镁消除废水中NO3-污染的离子方程式
(2)工业上从海水中提取MgCl2,并通过电解熔融MgCl2制得金属镁。若要除去1m3上述废水中的NO3-,至少需用含MgCl2质量分数为0.2%的海水多少千克?
答案 (1)5Mg + 2NO3- + 6H2O === 5Mg(OH)2↓+ N2↑+ 2OH-
(2)由 2NO3- -- 5Mg -- 5MgCl2 设海水质量为w(kg)
2mol 5×95g
1×103L×0.002mol/L w×103g/kg×0.2%
w = 237.5kg
24.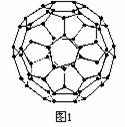 (2007学年度淮安市高三第二次调查测试)20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图1所示)的物质N60,计算机模拟结果显示,N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,
(2007学年度淮安市高三第二次调查测试)20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图1所示)的物质N60,计算机模拟结果显示,N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,
该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量,
2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮(局
部结构如右图2),这种高聚氮的晶体中每个氮原子都通过三根单键与其它氮原子
结合并向空间发展构成立体网状结构。
已知E(N-N)=167KJ/mol, E(N=N)=418KJ/mol,E(N≡N)=942KJ/mol。
(E表示键能,即打开1mol气态化学键所需要的能量)
回答下列问题:
 (1)N60和高聚氮的分子中每个N原子最外层有______个电子,
(1)N60和高聚氮的分子中每个N原子最外层有______个电子,
晶体类型______(填“相同”或“不同”);
(2)N60稳定性较差的原因可能是______________________________;
(3)写出N60晶体受热分解为N2热化学反应方程式:
___________________________________________;
(4)N60和高聚氮潜在的商业用途可能是____________________________________。
答案(1)8 不同 (2)N-N键能较小
(3)N60(S)=30N2(g);△H=-13230 kJ/mol
(4)用作高能量炸药或火箭燃料
23.(2007年浙江高考预测试题)如图所示(图中部分仪器未画出)有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连接,烧瓶中有0.384g Cu片,现向烧瓶中加入18mL 2.5mol·L-1的稀HNO3溶液,并立即用锡箔包住橡皮塞封住瓶口。试回答:
⑴欲提高铜与稀HNO3的反应速率,可采取多种不同的措施。若采用加入化学试剂的方法,可加入_____(填字母代号)。
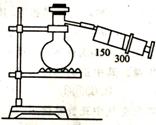 A.水 B.碳酸钠 C.少量的浓HNO3
图中还缺少的一种仪器是____________________。
A.水 B.碳酸钠 C.少量的浓HNO3
图中还缺少的一种仪器是____________________。
⑵橡皮塞用锡箔包住的原因是____________________________________________________。
⑶反应开始时,烧瓶中可观察到的主要现象有_______________________________________。
⑷停止反应后,轻轻推拉注射器活塞,使气体与气体,气体与液体皆充分反应。若忽略液体体积的变化,最终溶液中c(NO3-)与开始时相比____________(填字母代号)。
A.不变 B.变大 C.变小
答案 ⑴C 酒精灯 ⑵防止橡皮塞被HNO3蒸气腐蚀
⑶铜表面有气泡产生,且铜片溶解,溶液由无色变为蓝色,生成气体逐渐变成红棕色 ⑷ A
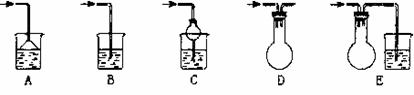
22.(北京市宣武区2007年高考化学模拟试题)(ⅰ) 实验室中吸收尾气的方法很多。下列装置中可以用来吸收氨气的是(填序号,多填倒扣分)____________________。
(ⅱ) 粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
⑴蒸发操作中使用到的瓷质仪器的名称为____________________。
⑵该同学将所得精盐配成溶液,用于另一实验。实验中需要用80mL,1mol/L的NaCl溶液,配制过程中用托盘天平称取的精盐质量为_________g,用于定容的玻璃仪器的规格和名称_______________________________。
答案 (ⅰ)ACE (ii)(1)蒸发皿 (2)5.9或5.8 100mL 容量瓶
21.(08温州市十校联合体高三联考)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是对演示实验改进后的装置(其中a、b、c为弹簧夹),试回答下列各问:
(1)甲装置中发生反应的离子方程式是 。
(2)和甲装置相比,乙装置的优点是 。
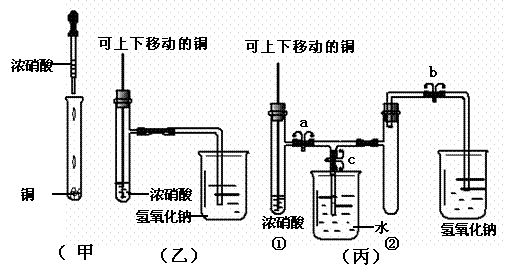
(3)为了进一步验证NO2和水的反应,某同学设计了丙装置。先关闭弹簧夹 (填a、b、c,后同),再打开弹簧夹 ,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作 。
(5)当②试管中的NO2和水充分反应,所得溶液物质的量浓度的最大值是 。(不考虑NO2与N2O4的转化且该实验条件下气体摩尔体积设为Vm L/mol)
答案(1)3Cu+8H++2NO3- = 3Cu2+ +2NO↑+4H2O
(2)可控制反应的发生和停止,反应产生的有毒气体能被吸收
(3) bc a
(4)关闭a然后打开c
(5)1/vmmol/L
19.(08山东高考冲刺预测卷)已知X、Y、Z、W是短周期元素中的四种非金属元素,它们的原子序数依次增大。X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出元素符号:Y_____________Z_________________W____________
(2)在一定条件下,由X单质与Z单质反应生成1molE放出的热量为46.2kJ,写出该反应的热化学方程式:_____________________________;E在催化剂存在的条件下,可用于还原汽车尾气中的_____________________,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效化肥,但长期施用会使土壤酸化,有关的离子方程式为_______________;由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为______________________________________。
(4)工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式_______________________。该反应中被氧化的E与参与反应的E的质量之比______________________。
答案 (1)C N O
(2)N2(g)+3H2(g) 2NH3(g);⊿H=-92.4kJ/mol NO或NO2
2NH3(g);⊿H=-92.4kJ/mol NO或NO2
 (3)NH4++H2O NH3·H2O+H+; NH4++HCO3-+2OH-
(3)NH4++H2O NH3·H2O+H+; NH4++HCO3-+2OH- NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
(4)8NH3+3Cl2=6NH4Cl+N2 1:4
解析:(1)氢原子失去电子后就成为质子,在短周期相邻元素的单质气体中,只有N2和O2是无色的;最外层电子数是内层电子数的2倍时,最外层电子数只有4个,不会是16个,所以X、Y、Z、W四种元素依次是H、C、N、O。(2)在一定条件下,H2和N2化合生成NH3,因为热化学方程式中1molN2(g)与3molH2(g)反应生成2molNH3(g),放出的热量就应为2×46.2kJ,所以热化学方程式为
N2(g)+3H2(g) 2NH3(g);⊿H=-92.4kJ/mol。汽车尾气中的含氮氧化物,在催化剂作用下可被NH3还原成N2。(3)H、N、O三种元素组成的化肥应为NH4NO3,它是强弱碱盐,水解呈酸性;X、Y、Z、W四种元素组成的盐只能是碳酸氢铵。(4)NH3与Cl2的反应中学没有学过,但题中告诉了产物有一种白烟,还有一种单质,就可推出生成物是NH4Cl和N2,就容易写出化学方程式了,分析化合价的变化并配平,本题就可顺利解决。
2NH3(g);⊿H=-92.4kJ/mol。汽车尾气中的含氮氧化物,在催化剂作用下可被NH3还原成N2。(3)H、N、O三种元素组成的化肥应为NH4NO3,它是强弱碱盐,水解呈酸性;X、Y、Z、W四种元素组成的盐只能是碳酸氢铵。(4)NH3与Cl2的反应中学没有学过,但题中告诉了产物有一种白烟,还有一种单质,就可推出生成物是NH4Cl和N2,就容易写出化学方程式了,分析化合价的变化并配平,本题就可顺利解决。
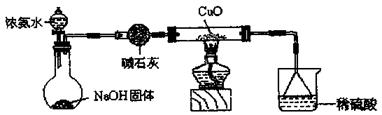 20.(08山东省沂水三中第二次诊断性)利用如图所示的装置和其他必要的仪器用品,完成下列实验。
20.(08山东省沂水三中第二次诊断性)利用如图所示的装置和其他必要的仪器用品,完成下列实验。
已知2NH3+3CuO N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是 稀硫酸的作用是 。
(2)浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
(3)证明NH3具有还原性的实验现象是
答案(1)吸收水蒸气(1分);吸收氨气,防止污染
 (2)NaOH吸收溶液中水分放热,使溶液温度升高,有利于NH3·H2O分解 氢氧根离子浓度增大,使NH3+H2O NH3·H2O
NH4++OH-平衡左移,也有利于氨气的逸出
(2)NaOH吸收溶液中水分放热,使溶液温度升高,有利于NH3·H2O分解 氢氧根离子浓度增大,使NH3+H2O NH3·H2O
NH4++OH-平衡左移,也有利于氨气的逸出
(3)黑色粉末变为红色,有无色液滴产生
17.(08山东潍坊模拟)硝酸盐受热分解的产物与其组成及受热温度等有关。
(1)一定条件下硝酸铵受热分解的化学反应方程式为:NH4NO3-HNO3+N2+H2O(未配平)
由该反应的氧化产物是 ,在反应中被氧化与被还原的氮原子数之比为
。
(2)某金属元素的硝酸盐受热分解的产物为不含氮元素的固体物质、NO2和O2。若产生的NO2和O2的物质的量之比为8:1,则金属元素的化合价在反应过程中 (填“升高”、“降低”或“不变”)。
答案(1)N2 5:3 (2)升高
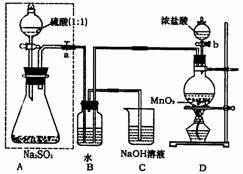 18.(08枣庄三诊)长期存放的亚硫酸钠可能会被空
18.(08枣庄三诊)长期存放的亚硫酸钠可能会被空
气中的氧气氧化。某化学兴趣小组通过
实验来测定苛无小亚硫酸钠试剂的被氧
化的程度,设计了右图实验:
请回答下面的问题:
(1)若将虚线框内的分液漏斗换成长颈漏
斗,则应该怎样检查虚线框内装置的
气密性?
(2)D装置中反应的化学方程式为 。B装置中反应的离子方程式为 。
(3)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为 。
(4)C装置中反应的离子方程式为 。
(5)现有以下试剂:蒸馏水、稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法测定试样中无水亚硫酸钠被氧化的程度
。
答案 (1)关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶内加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性良好,否则,说明装置漏气(答案要点为加点部分,其他答案只要合理也得分)
(2)MnO2+4HCl(浓)======MnCl2+Cl2↑+2H2O
Cl2+SO2+2H2O===4H++2Cl-+SO42-
(3)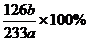
(4)Cl2+2OH-=Cl-+ClO-+H2O
(5)称取一定质量的样品置于烧杯中,加水溶解,依次加入足量盐酸和BaCl2溶液,过滤,洗涤,干燥,称量沉淀物质量,计算即可
(6)G装置不能吸收U型管中挥发出的氯化亚硝酰 将F装置换成一个盛有浓硫酸的洗气瓶(或在F、G之间加一个盛有浓硫酸的洗气瓶)
16.(2007年普陀区高三质量调研)向200mL 0.5mol/L的稀硝酸溶液中加入0.54g铝粉,放出448mL (S.T.P.) NO气体,经充分反应后,向所得溶液中,加入0.5mol/L NaOH溶液,生成 0.78g沉淀。加入氢氧化钠溶液体积可能为 ( )
A.100mL B.150mL C.180mL D.200mL
答案 AC
15.(泰安市2007年高三第二轮复习质量检测)最近,意大利罗马大学教授Fu Nvio Cacace等人获得了极具理论研究价值的N4分子。N4分子结构如图所示。己知断裂1mol N-N键需吸收167kJ热量,生成1molN≡N键会放出942kJ热量。根据以上信息和数据判断,下列说法中不正确的是
( )
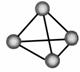 A.N4与N2互为同素异形体
A.N4与N2互为同素异形体
B.N4分子中原子间以共价键结合
C.N4分子与甲烷分子的结构相同
D.1molN4气体转化为N2时放出882kJ热量
答案 C
14.(安徽省皖南八校2007届高三第二次联考)氨气跟二氧化氮在一定条件下反应可生成氮气和水,若反应使用的是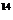 NH3和
NH3和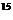 NO2,则所得氮气的摩尔质量g/mol约为:
( )
NO2,则所得氮气的摩尔质量g/mol约为:
( )
A.29.00 B.28.86 C.29.14 D.29.60
答案 B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com