
7. (湖北省大冶实验高中2010届第一次月考化学卷)把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是 A.SO2 B.Cl- C.Fe3+ D.NO3-
答案 D
6. (河南焦作十一中2010届高三上学期期中考试)已知下列反应 aFeCl2+bKNO3+cHCl == dFeCl3+gKCl+eH2O+fX 若b=1,d=3,X为生成物,其化学式应为
(A)N2 (B)NO2 (C)NO (D)NH3
答案 C
4.(湖北省孝感高中2010届高三上学期综合测试) 科学家根据自然界存在的N2制取N3,其后又陆续制取出N5、含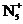 的化合物及N60。
的化合物及N60。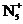 极不稳定,需保存在-80℃的干冰中;
极不稳定,需保存在-80℃的干冰中;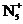 由于其极强的爆炸性,又称为“盐粒炸弹”;N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出来。分析上述 材料,下列说法中不正确的是(
)
由于其极强的爆炸性,又称为“盐粒炸弹”;N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出来。分析上述 材料,下列说法中不正确的是(
)
A.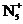 常温下会剧烈爆炸,体积急剧膨胀,放出大量的热
常温下会剧烈爆炸,体积急剧膨胀,放出大量的热
B.N60的发现开辟了能源世界的新天地,将来可能成为很好的火箭燃料
C.N2、N3、N5、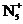 、N60互为同素异形体
、N60互为同素异形体
D.含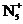 的化合物中既有离子键又有共价键
的化合物中既有离子键又有共价键
答案 C
5(湖北省孝感高中2010届高三上学期综合测试)青石棉(cricidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一。青石棉的化学式为Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO。下列说法中正确的是( )
A.青石棉是一种易燃品,且易溶于水
B.青石棉的化学组成用氧化物的形式可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
C.1mol Na2Fe5Si8O22(OH)2与足量的稀硝酸作用,可消耗4mol·L-1HNO3溶液5L
D. 1mol Na2Fe5Si8O22(OH)2与足量的氢氟酸作用,最多可消耗2mol·L-1HF溶液5.5L
答案 B.
3. (湖北省大冶实验高中2010届高三上学期期中考试)某氮的气态氧化物15.6L和过量的氢气混合,在一定条件下反应,使之生成液态水及无公害气体,恢复到原状态,反应后气体体积比反应前气体体积缩小了46.8 L,则原氮的氧化物的化学式为
A.NO2 B.N2O3 C.NO D.N2O
答案 B
2. (岳阳市一中2010届高三第二次质量检测)一定量的铁与一定量的浓HNO3反应,得到硝酸铁溶液和NO2、N2O4、NO的混合气体,这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铁溶液中加入2 mol·L-1 的NaOH溶液至Fe3+恰好沉淀,则消耗NaOH溶液的体积是 ( )
A.300 mL B.150 mL C. 120 mL D.90 Ml
答案 A
1、(2010届广西禾池中学高三上学期第一次月考)一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3―HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为( )
A.5:3 B.5:4 C.1:1 D.3:5
答案 A
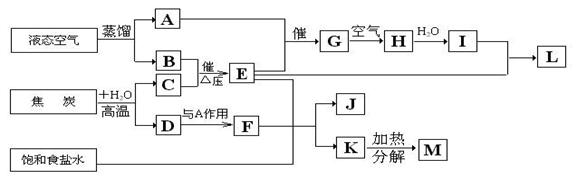
7. (福建省泉州七中2010届高三第二次月考)下图表示某化工生产的流程(有的反应条件和产物已略去)
 试回答:
(1)、C的分子式是
,L的名称是
。
(2)、写出A与E反应生成G的化学方程式:
(3)、G到H的反应中,氧化剂与还原剂的物质的量之比为
(4)、写出饱和食盐水与F和E反应生成J和K的化学方程式:
试回答:
(1)、C的分子式是
,L的名称是
。
(2)、写出A与E反应生成G的化学方程式:
(3)、G到H的反应中,氧化剂与还原剂的物质的量之比为
(4)、写出饱和食盐水与F和E反应生成J和K的化学方程式:
答案(1) H2; 硝酸铵
(2) 4NH3+5O2
 4NO+6H2O
4NO+6H2O
(3)1 :2 (4)NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3↓
题组五
6. (内蒙古一机一中2010届高三上学期期中考试)现有25℃时0.1mol·L-1的氨水。请回答下列问题:
(1)若向氨水中加入稀盐酸,使其恰好中和。反应的离子方程式是______________________;所得溶液呈_________性(填“酸”、“碱”或“中”);用离子方程式表示其原因:_________。
(2)若向氨水中加入少量氯化铵固体,此时溶液中_________,pH_________(填“增大”、“减小”或“不变”)。
(3)若向氨水中加稀NaHSO4溶液,至所得溶液pH =7。则所得溶液中c(NH4+)_______ c(SO42-)(填“<”、“>”或“=”)
答案 (1)NH3 ·H2O +H+=NH4++H2O (2分) 酸(1分)
NH4++H2O  NH3
·H2O +H+(2分)
NH3
·H2O +H+(2分)
(2)减少 (1分) 减少 (1分) (3) = (1分)
5. (广东省英德中学2010届高三第五次周测)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g)
 2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”,下同);使用催化剂
反应的△H_____________(填“增大” “减小” 或“不变”)。
2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”,下同);使用催化剂
反应的△H_____________(填“增大” “减小” 或“不变”)。
(2)已知:O2 (g)=O2+(g)+e-
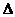 H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
PtF6(g)+ e- PtF6-(g)
PtF6-(g) 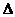 H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1
O2+PtF6-
(s)=O2+ (g)+ PtF6-(g) 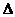 H3= 482.2 kJ·mol-1
H3= 482.2 kJ·mol-1
则反应O2(g)+ PtF6(g)= O2+PtF6-
(s) 的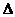 H=_____________。
H=_____________。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
(4)7℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g) N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
答案(1)向左;不变(各2分)(2)-77.6 kJ·mol-1(3分)(3)Cu(OH)2(3分);2NH3·H2O+Cu2+=Cu(OH)2↓+2 NH4+;(3分)(4)根据题意知平衡时: c(N2O4 )=0.0120mol·L-1 ,c(NO2)=0.0300mol·L-1 K= c(N2O4 )/c2(NO2) =0.0120/0.0300×0.0300 =13.3(4分)
4. (安徽省萧城一中2010届高三第三次月考)神舟6号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料是偏二甲肼[(CH3)2N-NH2]、氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是 , 产生该气体的化学方程为
。
(2)偏二甲肼在N2O4中燃烧的化学方程式为: ,当有1mol偏二甲肼燃烧时,转移电子的物质的量为 。
肼(N2H4)也是一种火箭燃料,N2H4与NH3有相似的化学性质。
(3)写出肼与盐酸反应的离子方程式: 。
(4)发射火箭时以肼为燃料,二氧化氮为氧化剂,两者反应生成氮气和气态水,已知4g的N2H4(g) 在上述反应中放出 71KJ 的热量, 写出该反应的热化学方程式:
。
答案(1)NO2 N2O4≒2NO2
(2)(CH3)2N-NH2+2N2O4=3N2+2CO2+4H2O 16mol
(3)N2H4+2H+=N2H62+ 或N2H4+H+=N2H5+
(4) N2H4 (g)NO2(g)=3/2N2(g)+2H2O(g);△H= -568KJ/mol (答案合理即可)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com