
11.主要物理量及单位:初速度(Vo):m/s;加速度(a):m/s2;末速度(Vt):m/s;时间(t)秒(s);位移(s):米(m);路程:米;速度单位换算:1m/s=3.6km/h 注:(1)平均速度是矢量;(2)物体速度大,加速度不一定大;(3)a=(Vt-Vo)/t只是量度式,不是决定式;(4)高中物理中理想化模型有质点、光滑平面、点电荷、理想气体、弹簧振子等
⑸V与ΔV的相同点是有相同的单位不同点是V是状态量,描述某时刻物体的运动状况,而ΔV是过程量,描述运动状态的改变情况。ΔV与a的相同点是有相同的方向不同点是ΔV表示速度改变了多少,而a表示速度的大小和方向改变的快慢程度
⑹平均速度与瞬时速度的关系是时间间隔趋向于零时的平均速度即为瞬时速度。速度与速率的关系是速度即表示物体运动快慢又表明运动方向,是矢量;速率只表示物体运动快慢是标量。速度与加速度的区别是速度描述物体运动状态,加速度描述运动状态改变的快慢联系是加速度是速度的变化率,高中出现的几个变化率加速度是速度的变化率、速度是位移的变化率、力是动量的变化率、感应电动势是磁通量的变化率
⑺.其它相关内容:质点、位移和路程、参考系、时间与时刻、、相遇、追及
2)自由落体运动
1.初速度Vo=0
2.末速度Vt=gt
3.下落高度h= (从Vo位置向下计算)
4.推论V2=2gh
注:(1)自由落体运动是初速度为零的匀加速直线运动,遵循匀变速直线运动规律;
(2)a=g=9.8m/s2≈10m/s2(重力加速度在赤道附近较小,在高山处比平地小,方向竖直向下)。
(3)竖直上抛运动
1.位移s=
(从Vo位置向下计算)
4.推论V2=2gh
注:(1)自由落体运动是初速度为零的匀加速直线运动,遵循匀变速直线运动规律;
(2)a=g=9.8m/s2≈10m/s2(重力加速度在赤道附近较小,在高山处比平地小,方向竖直向下)。
(3)竖直上抛运动
1.位移s=
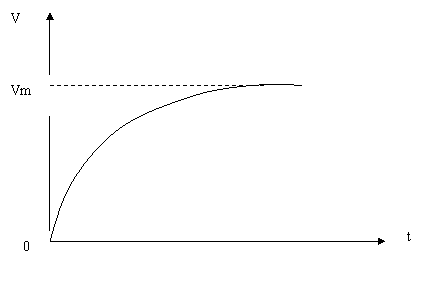
10.s--t图、v--t图.图像的物理意义位移随时间的变化关系和速度随时间的变化关系,截距的物理意义s--t图中与纵轴交点表示位置点,截距表示位移;与横轴交点表示时刻,截距表示时间。v--t图中与纵轴交点表示速度,截距表示速率;与横轴交点表示时刻,截距表示时间。斜率的物理意义s--t图中的斜率表示速度;v--t图中的斜率表示加速度,面积的物理意义v--t图中图象与坐标轴所围的面积表示位移。,画出几种典型运动的V-t图:
|
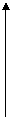 ①自由落体
①自由落体
|
|
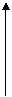 ②竖直上抛
②竖直上抛
 |
|||||
 |
|||||
|
|||||
③雨滴下落④汽车衡功率起动
9.匀变速直线运动的比例:
①初速为零的匀加速直线运动,在1s、2s、3s……ns内的位移之比为:12:22:32……n2;
②在第1s内、第2s内、第3s内……第ns内的位移之比为1:3:5……(2n-1);
③在第1米内、第2米内、第3米内……第n米内的时间之比为
1:: ……(
……(
④初速无论是否为零,匀变速直线运动的质点,在连续相邻的相等的时间间隔内的位移之差为一常数:Ds=aT2(a一匀变速直线运动的加速度T一每个时间间隔的时间)
6.位移s=V平t= 7.加速度a=
7.加速度a= {以Vo为正方向,a与Vo同向(加速)a>0;反向则a<0}
8.实验用推论Δs=
{以Vo为正方向,a与Vo同向(加速)a>0;反向则a<0}
8.实验用推论Δs= {Δs为连续相邻相等时间T内位移之差}
{Δs为连续相邻相等时间T内位移之差}
组差法求纸带加速度a=
5.中间位置速度VS/2=
1)匀变速直线运动
1.平均速度V平= (定义式)
2.有用推论
(定义式)
2.有用推论 =2as
=2as
3.中间时刻速度Vt/2=V平= 4.末速度Vt=
4.末速度Vt= =
=
(四)核电荷数、电子层数均不同的离子可选一种离子参照比较。例:比较r(K+)与r(Mg2+)可选r(Na+)为参照:r(K+)>r(Na+)>r(Mg2+)。
[思考感悟]核外电子排列的各条规律之间有怎样的关系?以19号元素K的原子结构示意图
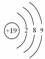
不能写成 为例来说明。
核外电子排布的几条规律之间既相互独立又相互统一,不能孤立地应用其中一条。第(3)、(4)条是对第(2)条的限制。如钾原子由于受第(3)条限制,最外层不能超过8个,故原子结构示意
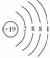
图为了 。
[基础训练]
1、甲、乙两元素原子的L层电子数都是其他层电子总数的2倍。下列推断正确的是( D )
A、甲与乙处于同一周期 B、甲与乙处于同一主族
C、甲与乙的单质都是原子晶体 D、甲与乙的原子序数之和为偶数
2、下列所述变化规律正确的是( D )
A、Na、Mg、Al还原性依次增强 B、HCl、PH3、H2S稳定性依次减弱
C、NaOH、KOH、CsOH碱性依次减弱 D、S2-、Cl-、K+、Ca2+离子半径依次减小
3、有三种金属元素A、B、C,在相同条件下,B的最高价氧化物的水化物的碱性比A的的最高价氧化物的水化物的碱性强;A可以从C的盐溶液中置换出C。则这三种金属元素的原子失电子能力由强到弱的顺序是( B )
A、A>B>C B、B>A>C C、B>C>A D、C>B>A
[高考模拟]
4、(2007山东高考)下列关于元素的叙述正确的是( A )
A、金属元素与非金属元素能形成共价化合物
B、只有在原子中,质子数才与核外电子数相等
C、目前使用的元素周期表中,最长的周期含有36种元素
D、非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
5、(2008聊城模拟)原子序数依次相差1,现有由小到大排列的A、B、C、D、E五种短周期元素。下列是有关这五种元素的叙述:①若A的最高价氧化物的水化物是强碱,则E的最高价氧化物的水化物一定是强酸;②若A的单质既能与强酸又能与强碱反应且都放出氢气,则这五种元素在同一周期;③若A的阳离子比E的阴离子少8个电子,则D一定是非金属元素;④若D的最高价氧化物的水化物是强酸,则E的单质在常温下为气态。其中正确的是( B )
A、①②③ B、②③④ C、①③④ D、①②④
(三)带相同电荷的离子,电子层数越多,半径越大。例:r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+),r(O2-)<r(S2-)<r(Se2-)<r(Te2+)。
(二)电子层结构相同的微粒,核电荷数越大,半径越小。例:r(O2-)>r(F-)>r(Ne)>r(Na+)>r(Mg2+)>r(Al3+)。
(一)同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。例:r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com