
2.下图所示的公私经济成分比例,反映的是我国 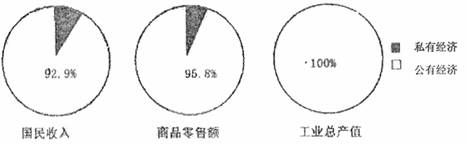
A.1949年的情况 B.1952年的情况 C.1953年的情况 D.1956年的情况
1.我国社会主义工业化起步于
A.中共七届二中全会的召B.中华人民共和国的成C.社会主义国营经济的建立 D.第一个五年计划的实行
24. 对于2X(g)
 Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。
Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。
|
|
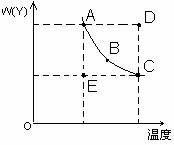
(1)该反应的正反应方向是一个______反应(填“吸热”或“放热”)。
(2)A、B、C、D、E各状态中,υ正<υ逆的是______。
(3)维持t1不变,E→A所需时间为x,维持t2不变, D→C所需时间为y,则x___y(填“<、>或=”)。
(4)欲要求使E状态从水平方向到C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是_____。
23.在一定条件下,二氧化硫和氧气发生如下反应:
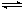 2SO2(g)+ O2
(g) 2SO3(g)△H<0
2SO2(g)+ O2
(g) 2SO3(g)△H<0
(1)写出该反应的化学平衡常数表达式 K=____
(2)降低温度,该反应K值____,二氧化硫转化率____,
化学反应速率____。(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将SO2和O2混合,反应过
程中SO2、O2、SO3物质的量变化如图,反应处于平衡
 状态的时间是______。(有几段填几段)
状态的时间是______。(有几段填几段)
(4)据图判断,反应进行至20min时,曲线发生变化的原因是____(用文字表达)。10min到15min的曲线变化的原因可能是____(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d..增加SO3的物质的量
22. 用已知浓度的盐酸滴定某未知浓度的氢氧化钠溶液,根据实验回答:
(1)准确称取4.1g烧碱样品,所用仪器除药匙外还有____
(2)将样品配成250mL待测液,需要的仪器除烧杯、玻璃棒、还有____
(3)取10.00mL待测液,用_________量取.
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手_____,右手_____,两眼注视______,直到滴定终点。
(5)所选用的指示剂为______,滴定终点的现象:_______。
(6)下列操作可能使测定结果如何? (填写偏高、偏低、无影响)
①酸式滴定管在装液前未用标准盐酸溶液润洗2次-3次。( )
② 开始实验时,酸式滴定管尖嘴部分有气泡,在滴定过程中,气泡消失。( )
 ③滴定过程中,锥形瓶内溶液立即褪成无色且颜色不再变红。( )
③滴定过程中,锥形瓶内溶液立即褪成无色且颜色不再变红。( )
④ 达到滴定终点时,俯视溶液凹面最低点读数。( )
21. 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。
⑴反应的热化学方程式为-------------
⑵又已知H2O(l) = H2O(g); △H=+44kJ/mol,则16g液态肼和液态双氧水反应生成液态水时放出的热量是---------
⑶此反应用于火箭推进,除释放大量的热和快速产生大量气体外还有一个很大的优点是-----
20. 在一密闭容器中充入2 mol A和1 mol B发生反应:2A(g)+B(g)  xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol,B:0.3 mol,C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%。则x的值为
xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol,B:0.3 mol,C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%。则x的值为
A.只能为2 B.只能为3 C.只能为4 D.可能为2或3
第Ⅱ卷 非选择题(共50分)
19. 在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是
A. H+ 的物质的量 B. 醋酸的电离常数
C. 中和时所需NaOH的量 D. CH3COOH的物质的量
18.在密闭容器中,发生反应:xA(g)+yB(g) zC(g)。反应达到平衡时,A的浓度为0.5mol/L;若保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡时A的浓度降为0.3mol/L。下列判断正确的是
zC(g)。反应达到平衡时,A的浓度为0.5mol/L;若保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡时A的浓度降为0.3mol/L。下列判断正确的是
A. x+y<z B. 平衡向正反应方向移动
C. B的转化率升高 D. C的体积分数下降
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com