
4、大学生活:学习法律、兴趣广泛、研究哲学:黑格尔、费尔巴哈
3、崇高理想:为人类谋幸福
|
《青年在选择职业时的考虑》: 17岁的马克思中学毕业考试中的德语作文。作文引起了他的老师的注意,文章中深刻的思想内容为教师们所惊叹,给老师们留下了深刻的印象。 “如果人只是为了自己而劳动。他也许能成为有名的学者、绝顶的聪明人、出色的诗人,但他绝不可能成为真正的完人和伟人。 如果我们选择了最能为人类福利而劳动的职业,我们就不会为它的重负所压倒,因为这是为全人类所作的牺牲;那时我们感到的将不是一点点自私而可怜的欢乐,我们的幸福将属于千万人,我们的事业并不显赫一时,但将永远存在;而面对我们的骨灰,高尚的人们将洒下热泪。” |
2、中学时代
1、伟人诞生:1818年5月5日,德国莱茵省特里尔市
|
马克思生于普鲁士莱茵省特里尔城一个犹太人律师家庭。父亲亨利希·马克思,犹太人,律师。母亲罕丽达·普雷斯堡,荷兰人,有教养妇女。 |
15. ⑴ 0.92 ⑵ 0.826 ⑶ Fe0.76Fe0.16O ⑷ 正八面体
10.④ 11.29.3/a3ρ 12.-1638kJ/mol 13.⑴ Na Si P ⑵ (氯化镁,略)
⑶ Al(OH)3+OH-=AlO2-+2H2O ⑷ 原子 4n 14.⑴ 207g/mol ⑵ 6 ⅣA ⑶ 因R4+氧化性大于Fe3+,故:Pb4++2Fe2+=Pb2++2Fe3+
⑷ Pb3O4+4HNO3=PbO2+2Pb(NO3)2+2H2O
16.有A、B、C、D四种元素,其中A、B、C为短周期元素,A元素所处的周期数、主族序数、原子序数均相同;BO3-离子含有32个电子;C元素最外层电子数比次处层少2个,C的阴离子和D的阳离子有相同的电子层结构,C和D可形式化合物D2C
(1)B元素的名称是_________,A、B两元素形成的化合物的电子式是_________,其分子的空间构型是_________。
(2)A、B、C可形成两种既含离子键又含共价键的化合物,它们分别是_________,_________ (3)D:C的化学式是_________,用电子式表示其形成过程_________
第十三讲
例题:1.AC 2.A 3.B 4.⑴ 20 12 ⑵ 一个碳与三个碳相连,一个碳原子形成两个C-C和一个C=C ⑶ A C
当堂反馈:1.略2略.3. 略 4.C 5.A 6.C 7.⑴ Fe2Al ⑵
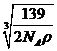 ⑶ 2 0.1
⑶ 2 0.1
课后练习:1.⑴D ⑵B 2.A 3.AB 4.C 5.B 6.C 7.B 8.D 9.C
15.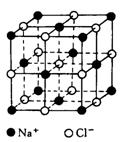 晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。NaCl晶胞结构如图所示,已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为5.71g/cm3,晶胞棱长为4.28×10-10m(铁的相对原子质量为55.9,氧的相对原子质量为16)。求:
晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。NaCl晶胞结构如图所示,已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为5.71g/cm3,晶胞棱长为4.28×10-10m(铁的相对原子质量为55.9,氧的相对原子质量为16)。求:
⑴ FexO的x值(精确到0.01)为 ;
⑵ 晶体中的Fe分别为Fe2+、Fe3+,在Fe2+、Fe3+的总数中,Fe2+所占分数(用小数表示,精确到0.001)为 ;
⑶ 此晶体化学式为 ;
⑷ Fe在此晶体中占据空间的几何形状是 体。(即与
O2-距离最近且相等的铁离子围成的空间形状)
14.某元素R具有微弱的放射性,某原子核内中子数比质子数多43。由R组成的固体单质A,在一定条件下密度为6.88g/cm。用X射线研究固体A表明,在边长为1.00×10-7cm的立方体中含有20个原子。R在化学反应中常表现为+2价、+4价。在溶液中R2+稳定,而R4+有强氧化性,可将NO氧化为HNO3。氧化物R3O4的性质与Fe3O4有些类似。R的另一种质量数比R少2的同位素较为稳定,与铁可形成合金,在潮湿环境中易形成铁锈。R的单质及化合物在工农业生产、医疗卫生、科学技术等各个领域都有很多用途。请回答:
⑴ R原子的摩尔质量为 ;
⑵ R元素处于周期表中第 周期 族;
⑶ 假若使少量R4+加到Fe(NO3)2溶液中,是否会发生反应?若“否”,说明原因;若“是”,请写出离子方程式: ;
⑷ R3O4因具有氧化性,被大量用于油漆涂料,涂在钢铁表面,有利于形成耐腐蚀的钝化层。R3O4与足量HNO3反应,生成R的氧化物,R的硝酸盐和水三种物质,此反应的方程式为 。
13.A、B、C、D、E、F为原子序数依次增大的主族元素。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3。回答:⑴ 写出下列元素的符号:A 、D 、E ;⑵ 写出B、F形成的化合物的电子式 ;⑶ A、C两种元素最高价氧化物的水化物反应的离子方程式为 ;⑷ D的固态氧化物是 晶体,含nmolD的氧化物的晶体中含D-O共价键为 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com