
2.形成条件
(1)具有活动性不同的电极
(2)具有电解质溶液
(3)具有(导线相连组成)闭合回路。
1.定义:将化学能转化为电能的装置称为原电池
2.新能源的开发利用:由于新能源具有资源丰富、可再生、污染小或没污染等特点,因此新能源的开发利用是当今的一个重要课题。而其中最有希望开发利用的新能源为太阳能、氢能、风能、地热能、生物能、燃料电池等。
凡是能提供某种形式能量的物质,或是物质的运动,统称为能源。它是发展工农业.国防和科学技术以及提高人们生活水平等的重要物质基础。能源通常是指煤、石油、天然气等化石燃料以及各种火力、水力等发电手段;而氢能、太阳能、核电、风能、地热等称为新能源。
1.化石燃料的利弊:目前使用最多的燃料是煤、石油、天然气等,它们是由古代动植物的遗体在地层下,经过一系列复杂漫长的变化而逐渐形成的。它们是一种非再生能源,所以称为化石燃料。化石燃料的开发利用,保证人类社会的不断发展和进步。但这些能源的开发利用也带来了一些弊端,如:环境污染、酸雨、温室效应等。同时化石燃料储量有限,不可再生,因此提高燃料的效率是国民经济建设中一项长期的战略任务和当务之急。
2.反应热(焓)的计算
⑴盖斯定律: 化学反应的热效应只与反应的最初状态和生成物的最终状态有关,而与这个反应的变化途径无关。即对于一个化学反应,无论是一步完成还是分几步完成,其反应的热效应是一样的。
例:已知C(s,石墨)+ O2(g)= CO2(g) ΔH1 = -393.5kJ·mol-1
CO(g)+ 1/2 O2(g)= CO2(g) ΔH2 = -283.0kJ·mol-1
求 C(s,石墨)+ 1/2 O2(g)= CO(g)的ΔH
由盖斯定律可得:ΔH +ΔH2 = ΔH1
所以ΔH =ΔH1 -ΔH2 = -393.5kJ·mol-1 + 283.0kJ·mol-1 = -110.5 kJ·mol-1
⑵根据热化学方程式计算:例已知H2(g)+Cl2(g)=2HCl(g),△H=-184.6 kJ / mol,求反应HCl(g) = H2(g)+ Cl2(g)的△H?解:由热化学方程式可知生成2mol HCl气体放出184.6 kJ 热量,因此1mol HCl气体分解需吸收热量184.6 kJ ÷2 = 92.3 kJ 所以△H = + 92.3 kJ / mol。
⑶由生成反应的焓变计算:
例298K时,Ca(s) + C(s,石墨)+ 3/2 O2(g)= CaCO3(s) △H1=-1206.8kJ·mol-1 ①
Ca(s) + 1/2 O2(g)= CaO(s) △H2=-635.1kJ·mol-1 ②
C(s,石墨)+ O2(g)= CO2(g) △H3=-393.5 kJ·mol-1 ③
计算CaCO3(s) = CaO(s) + CO2(g) △H4= ?
解:由化学方程式②+③-①可得反应式CaCO3(s) = CaO(s) + CO2(g)
所以△H4= △H2 + △H3 - △H1 = -635.1kJ·mol-1-393.5 kJ·mol-1 –(-1206.8kJ·mol-1)
= 178.2 kJ·mol-1 (注:焓变的加减等换算要与方程式的加减等换算一致)
⑷反应热的大小比较:
①同一反应生成物状态不同时A(气)+B(气)=C(气)+Q1 A(气)+B(气)=C(液)+Q2
因为C(气)→C(液)要放出热量,所以Q2>Q1。
②同一反应,反应物状态不同时 S(气)+O2(气)=SO2(气)+Q1 S(固)+O2(气)=SO2(气)+Q2
因为S(固) → S(气)需吸收热量,所以Q1>Q2。
③两个有联系的不同反应相比C(固)+ O2(气)= CO2(气)+ Q1
C(固)+ 1/2 O2(气)= CO(气)+ Q2 因Q1是1molC完全燃烧放出的热量,而Q2是1molC不完全燃烧放出的热量, 所以Q1>Q2。
1.热化学方程式
⑴概念:表明反应所放出或吸收的热量的化学方程式,叫热化学方程式
⑵热化学方程式的含义:以反应C(s,石墨)+O2(g)= CO2 (s)ΔH = -393.5kJ·mol-1为例,它表示1mol石墨固体与1mol O2气体完全化合生成1mol CO2气体时放出393.5kJ的热量。(注意:热化学方程式中各物质前边的系数只表示物质的量,所以可以是分数。而不代表几个分子或原子。ΔH的单位kJ·mol-1是指反应方程式中的物质用“mol”来衡量时,所对应的能量变化是多少kJ,并非特指“1mol物质参加反应时,吸收或放出的热量”。)
⑶书写热化学方程式应注意的几点:①表示焓变的数值ΔH写在方程式的右边,吸热反应在数值前加“+”号,放热反应在数值前加“-”号,单位用kJ·mol-1表示。②必须在各物质的化学式后边注明各物质的聚集状态或晶型。③反应系数只表示物质的量,不表示分子数,因此系数可以是分数,也不用最简系数,但要注意焓变数值与相应的方程式相配。如:
2H2(g)+ O2(g)= 2H2O(l)ΔH = -571.6kJ·mol-1
H2(g)+ 1/2O2(g)= H2O(l)ΔH = -285.8kJ·mol-1
两个式子都对,但意义不尽相同。
④需注明测定的温度和压强,若不注明则指25℃.101 kPa条件。
3.反应热与焓变的关系:
|
|
反应热 |
焓变 |
|
含义 |
化学反应中释放或吸收的热量 |
化学反应中生成物总焓与反应物总焓之差 |
|
符号 |
Q |
ΔH |
|
与能量变化的关系 |
Q > 0 反应吸收热量 Q < 0反应放出热量 |
ΔH > 0 反应吸收热量 ΔH < 0反应放出热量 |
|
二者的相互联系 |
在等压条件下(即敞口容器中)进行的化学反应,如果反应中物质的能量变化全部转化为热能,而没有转化为电能、光能等其它形式的能,则该反应的反应热就等于反应前后物质的焓的改变,即 QP = ΔH (QP表示在压强不变条件下化学反应的反应热) |
|
|
与键能的关系 |
ΔH = QP = 反应物的总键能 - 生成物的总键能 |
2.反应焓变:生成物的总焓与反应物的总焓之差,用符号ΔH表示。
1.焓:焓是用来描述物质所具有的能量的物理量,用符号H表示。
2.反应热及热效应的分类:
⑴反应热的分类:根据反应类型和研究对象的不同,反应热可分为生成热、分解热、中和热.燃烧热、溶解热等。
① 中和热:在稀溶液中,酸与碱发生中和反应生成1molH2O时所放出的热量。
② 燃烧热:是指在25℃.101kPa下,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
⑵热效应的分类:分为吸热反应、放热反应。
吸热反应和放热反应的比较
|
类型 比较 |
吸热反应 |
放热反应 |
|
|
定义 |
吸收热量的化学反应 |
放出热量的化学反应 |
|
|
实质 |
总能量关系 |
∑E(反应物)<∑E(生成物) |
∑E(反应物)>∑E(生成物) |
|
总键能关系 |
反应物的总键能>生成物的总键能 |
反应物的总键能<生成物的总键能 |
|
|
表示方法 |
Q > 0 |
Q < 0 |
|
|
图示 |
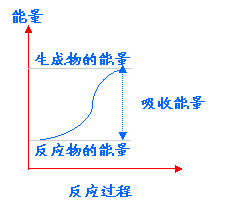 |
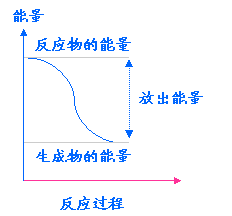 |
|
|
反应类型或实例 |
①
所有的水解反应 ② 所有的电离反应 ③ 大多数的分解反应 ④ Ba(OH)2·8H2O与NH4Cl的反应 ⑤ C+H2O  CO+H2 CO+H2 |
①
所有的中和反应 ② 所有的燃烧反应 ③ 大多数的化合反应 ④绝大多数的置换反应 |
⑶反应热的测量(了解)
① 仪器:量热计
② 实验原理:Q = C(T2-T1)(C表示体系的热容; T1、T2分别表示反应前和反应后体系的热力学温度)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com