
14.
|
组成该磁性材料的元素是 |
钡、铁、氧 |
|
各元素的质量比是 |
钡∶铁∶氧 = 2.74∶2.24∶1.28 |
|
各元素的原子个数比是 |
Ba∶Fe∶O = 1∶2∶4 |
|
该磁性材料的化学式为 |
BaFe2O4 (或BaO、Fe2O3) |
提示:(1)经分析,可初步判断2.33g固体是BaSO4, 0.80g固体是Fe2O3.
设:6.26g样品中含钡元素,铁元素的质量分别为x、y
Ba-BaSO4
137y 233y
x 2.33g×2 x = 2.74g
2Fe-Fe2O3
112y 160g
y 0.80g×4 y = 2.24g
则6.26g样品中含氧元素的质量为:6.26g -2.74g-2.24g = 1.28g
(2)该磁性材料中
Ba∶Fe∶O = 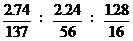 = 1∶2∶4
= 1∶2∶4
该磁性材料的化学式为BaF2O4
Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3
Ba-BaSO4 ∵ 取了50mL ∴ 相当于2.33×2是100mL中的Ba
2Fe-Fe2O3, 50mL中取25mL ∴ 50mL为0.8×2, 100mL为 0.8×2×2 = 0.8 × 4g
13.A:AgNO3 B: MgCl2 C:CuSO4 D:NaOH
12.(1)H2 (2)4Fe2+ + 8NH3·H2O + O2 + 2H2O = 4Fe (OH)3 ¯ + 8NH4+
(3)Al3+和Na+ (4)H2SO4 (HNO3)
11.(1)过量Fe粉
(2)银和过量的Fe粉
(3)过量的稀H2SO4
(4)H+、Na+、Fe2+
10.
|
溶 液 |
A |
B |
C |
D |
E |
|
阳离子 |
Na+ |
Ag+ |
Fe3+ |
Al3+ |
Ba2+ |
|
阴离子 |
CO32- |
NO3- |
SO42- |
Cl- |
OH- |
9、(1)Al和Fe
(2)2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
(3)Fe3+
+ 3OH- = Fe(OH)3¯ 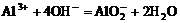
(4)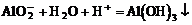
8.a = b < 4,2, 提示:本题属于字母型讨论计算问题,有一定难度,但题中已作了限制“反 应后所得两种溶液质量相等”,因而只可能盐酸足量,否则就不合题意了。
∵n (HCl) = 0.1×1 = 0.1(mol).
MgCO3 + 2HCl = MgCl2 + CO2 + H2O
84 2 44
a 0.1 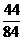 a
a
MgCO3与盐酸刚好反应时a = 4.2g
NaHCO3 + HCl = NaCl + CO2 + H2O
84 1 44
6
6.1
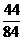 b
b
NaHCO3与盐酸刚好反应时b = 8.4g
要满足题设应有: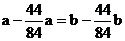 ,即a = b
,即a = b
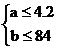 综合考虑得a = b < 4.2
综合考虑得a = b < 4.2
1.A 2.C 3.AD 4.A 5.B 提示:还原性:Fe > Cu,氧化性:Fe 3+ > Cu2+ > Fe2+, Fe先于Cu参加反应,烧杯中不可能有Fe无Cu。6.B 7.FeBr2
15.取一根镁条置于坩锅内点燃,得到氧化镁和氮化镁混合物的总质量为
470g. 冷却后加入足量水,将反应产物加热蒸干并灼烧,得到的氧化镁质
量为0.486g。
⑴写出氮化镁与水反应生成氢氧化镁和氨的化学方程式。
⑵计算燃烧所得混合物中氮化镁的质量分数。
第四课时 金属的冶炼
[针对训练]
14.为测定一种复合氧化物型的磁性粉末材料的组成,称取6.26g样品,将其全部溶于过量稀硝酸后,配成100mL溶液。取50mL溶液,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤,烘干后得2.33g固体。另取25mL溶液,加入少许KSCN溶液,显红色。再取余下的25mL溶液,加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤,灼烧后的0.80g固体。请计算并结合推理填写下表。
|
组成该磁性材料的元素是 |
|
|
各元素的质量比是 |
|
|
各元素的原子个数比是 |
|
|
该磁性材料的化学式为 |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com