
1.下列关于细胞结构的说法中,正确的是 ( )
A.细胞的细胞壁都可以通过纤维素酶把它分解掉
B.同时具有中心体和叶绿体的细胞一般是低等植物细胞
C.蓝藻在生物进化中起着重要的作用是因为它具有叶绿体能进行光合作用
D.细胞中具有双层膜的细胞器是叶绿体.线粒体和细胞核
31、(10分)用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。
实验记录见下表:
|
实验次数 |
称取样品的质量/g |
所加Ba(OH)2溶液的体积/L |
测得生成沉淀质量/g |
|
1 |
0.858 |
0.5 |
1.379 |
|
2 |
1.716 |
0.5 |
|
|
3 |
2.574 |
0.5 |
4.137 |
|
4 |
3.432 |
0.5 |
5.516 |
|
5 |
4.290 |
0.5 |
5.516 |
|
6 |
5.148 |
0.5 |
5.516 |
回答下列问题:(1)第2次实验中产生沉淀质量是多少克,请将结果填在表格相应空格
(2)判断第1、2、3次实验中,Ba(OH)2溶液的用量:
A 恰好 B不足量 C过量
写出第1、2、3次实验中发生反应的离子方程式:
(3)样品中NaHCO3和K2CO3的物质的量之比是 ;
30、(10分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
① 用蓝色石蕊试纸检测该溶液,试纸显红色;
② 取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③ 取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④ 取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤ 取实验 ④ 后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
⑴用简要语言描述在实验 ① 中的操作
⑵根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是______________________。
⑶写出与②③两个实验有关的离子方程式:
②_____________________________________________________________
③_____________________________________________________________
29、(12分)利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:
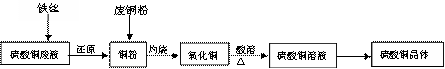
试回答下列问题:
(1) 废铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂是 ,该还原反应的化学方程式是
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是
28、(12分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 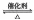 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的生成速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.生高温度
(3)混合气体通过过量NaOH溶液,气体体积减少了21.28L,该减少的气体是:
(4)反应达到平衡时生成SO3的物质的量是:
(5)求该反应达到平衡时SO2的转化率(用百分数表示)
(6)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀 克
27、(4分)(1)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃10kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧的热化学方程式:
(2)已知:CH3OH+Cr2O72-+8H+
CO2↑+2Cr3++6H2O
写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
26、足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与15.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入 5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.600mL B.450mL C.560mL D.150mL
25、将几种铁的氧化物的混合物投入到7mol/l的盐酸100 ml 中。恰好完全溶解 ,在所得的溶液中再通入0.56L(标况)氯气时,刚好使溶液中Fe2+ 完全转化为Fe3+ 。则该混合物中铁元素的质量分数为( )
A 74.1% B 72.4% C 71.4% D 63.6%
24、下列表述中正确的是( )
A.1mol NaOH分别和1mol CH3COOH、1molHNO3反应,后者比前者放出的热量多
B.由C(石墨)→C(金刚石)△H=+119kJ·mol-1可知,金刚石比石墨稳定
C.在AgNO3溶液中加入过量的稀盐酸后,溶液中不存在Ag+
D. 任何能使熵值增大的过程都能自发进行
23、将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是 ( )

A.CO2 B.NH3
C. C12 D.H2S
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com