
3.运用上表资料,指出不正确的说法是:( )
A.我国农村妇女的生育率高于城市
B.生育率与受教育程度成反比
C.城乡妇女的生育率差异与受教育程度成反比
D.80年代以前,我国城乡育龄妇女生育子女的平均数都超过2人
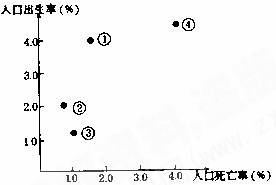 右图反映四个国家的人口出生率和死亡率,读图回答1-2题。
右图反映四个国家的人口出生率和死亡率,读图回答1-2题。
1.人口再生产类型属于“现代型”的国家是:( )
A.③ B.②
C.① D.④
2.与右图中①的出生率、死亡率相接近的国家最有可能是:( )
A.中国 B.尼日利亚
C.英国 D.澳大利亚
按受教育程度统计的我国35岁到45岁妇女生育的子女数(1981年)
|
地区 |
文盲 |
小学 |
中学 |
高中 |
大专以上 |
|
农村 |
4.78 |
3.99 |
3.52 |
3.17 |
2.22 |
|
城市 |
3.97 |
3.14 |
2.60 |
2.21 |
1.92 |
10、在25℃,101kPa条件下,将 ,通入10LCO和
,通入10LCO和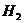 的混合气
的混合气 中,使其完全燃烧,干燥后,恢复至原来的温度和压强
中,使其完全燃烧,干燥后,恢复至原来的温度和压强
(1)若剩余气体的体积是15L,则原CO和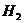 的混合气中
的混合气中
V(CO)=

(2)若剩余气体的体积为aL,则原CO和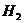 的混合气中__________
的混合气中__________
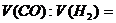 ( )
( )
(3)若剩余气体的体积为aL,则a的取值范围是__________
(1)5 10
(2)(a-10):(20-a)
(3)10<a<20
例11:用含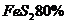 的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失
的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失 率为2%,求生产500t98%的硫酸需矿石的质量和标况下空气的体积。(假设空气中氧气的体积分数为20%)。
率为2%,求生产500t98%的硫酸需矿石的质量和标况下空气的体积。(假设空气中氧气的体积分数为20%)。
解析:设需要矿石的质量为x;氧气物质的量为 y。本题涉及的化学方程式为:
y。本题涉及的化学方程式为: 另外,氧气参与了两个反应,可将①+②×4+③×8,整理后得出相应的关系式:
另外,氧气参与了两个反应,可将①+②×4+③×8,整理后得出相应的关系式:

15mol 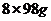
y 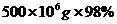
解之得: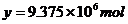
则所需空气 的体积:
的体积: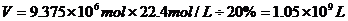 。
。
例12:工业上生产电石是用生石灰与焦炭在电炉内加热进行的
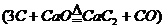 ,假设原料的利用率为95%,则36t焦炭可生产多少t乙炔?
,假设原料的利用率为95%,则36t焦炭可生产多少t乙炔?
解析:本题依据题给化学方程式,用关系式法列式:

解之得: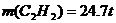
例13:为测定某石灰石中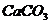 的质量分数,称取Wg石灰石样品,加入过量的浓度为6mol/L的盐酸,使它完全溶解,加热煮沸,除去溶解的
的质量分数,称取Wg石灰石样品,加入过量的浓度为6mol/L的盐酸,使它完全溶解,加热煮沸,除去溶解的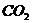 ,再加入足量的草酸铵
,再加入足量的草酸铵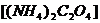 溶液后,慢慢加入氨水降低溶液的酸度,则析出草酸钙沉淀:
溶液后,慢慢加入氨水降低溶液的酸度,则析出草酸钙沉淀: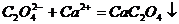 ,过滤出
,过滤出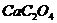 后,用稀
后,用稀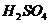 溶解:
溶解: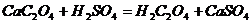 ,再用蒸馏水稀释溶液至
,再用蒸馏水稀释溶液至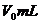 ,取
,取 出
出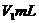 用
用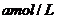 的
的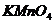 酸性溶液滴定,此时发生反应:
酸性溶液滴定,此时发生反应: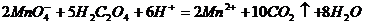 ,若滴定终点时消耗amol/L的
,若滴定终点时消耗amol/L的 ,计算样品中
,计算样品中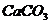 的质量分数。
的质量分数。
解析:设生成沉淀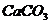 物质的量为x
物质的量为x
本题涉及到化学方程式或离子方程式为:

9、 将a mol的
将a mol的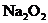 和
和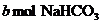 固体混合后,在密闭容器中加
固体混合后,在密闭容器中加 热到250℃,让其充分反应,假设
热到250℃,让其充分反应,假设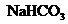 分解产生的
分解产生的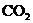 与
与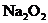 反应完后,
反应完后,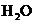 再与
再与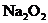 反应.
反应.
(1)当剩余固体为 ,排出气体为
,排出气体为 ,
,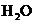 时,
时,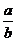 的值为________.
的值为________.
(2)当剩余固体为 ,NaOH,排出气体为
,NaOH,排出气体为 ,
,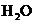 时,
时,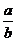 的值为________.
的值为________.
(3)当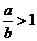 时,剩余固体为________,排出气体为________.
时,剩余固体为________,排出气体为________.
(4)当排出的 和
和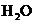 为等物质的量时,则
为等物质的量时,则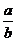 的值为________.
的值为________.
解析:题中涉及化学反应如下:
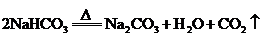 ①
①
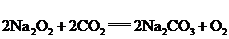 ②
②
 ③
③
(1)当剩余固体为 ,排出气体为
,排出气体为 、
、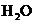 时,因为没有NaOH生成,水未与
时,因为没有NaOH生成,水未与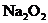 反应.将方程式①×2+②得:
反应.将方程式①×2+②得: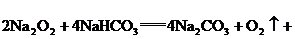

由方程式可知: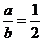 .
.
(2)当剩余固体为 、NaOH,排出气体为
、NaOH,排出气体为 、
、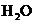 时,由于有NaOH生成,所以有水与
时,由于有NaOH生成,所以有水与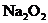 反应.假设反应后无
反应.假设反应后无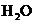 生成,将方程式①×2+②+③得:
生成,将方程式①×2+②+③得:
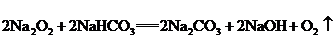
由方程式可知此时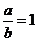 .因为有水生成,所以
.因为有水生成,所以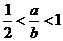
(3)当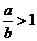 时,由2讨论可知:剩余固体为
时,由2讨论可知:剩余固体为 、NaOH、
、NaOH、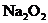 ;排出气体为
;排出气体为 .
.

所以,反应中消耗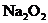 的物质的量为:
的物质的量为: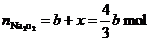 ,用去
,用去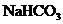 的物质的量为:
的物质的量为: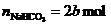
所以,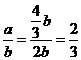
8、在已平衡的托盘天平左右托盘上各放一等质量的烧杯,并分别往烧杯中注入5 mol/L盐酸60 mL.向左盘烧杯中放入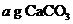 粉末,往右盘烧杯中加入x g A物质粉末,充分反应后天平仍保持平衡.
粉末,往右盘烧杯中加入x g A物质粉末,充分反应后天平仍保持平衡.
(1)若A为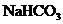 .
.
①当a≤15时,x的值为________(用含a的代 数式表示,以下同).
数式表示,以下同).
②当18.6≥a>15时,x的值为________.
③当a>18.6时,x的值为________.
(2)若A为 ,且两只烧杯中均无固态物质存在,则x的取值必须满足的条件是________.
,且两只烧杯中均无固态物质存在,则x的取值必须满足的条件是________.
解析:这是一道天平平衡问题的计算.两个烧杯的质量相等.两个烧杯里盐酸溶液的质量相等.因此论证天平两个烧杯内反应体系质量改变量相等是解决本题的关键.由题意可知:
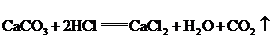 溶液增重
溶液增重
100 56
a 0.56a
 溶液
溶液 增重
增重
84 40
x 40x/84
当0.3 mol HCl与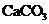 恰好完全反应时,消耗
恰好完全反应时,消耗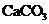 的质量为:
的质量为: 时;0.3
mol HCl与
时;0.3
mol HCl与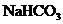 恰好完全反应,消耗
恰好完全反应,消耗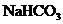 的质量为:0.3×84=25.2 g
的质量为:0.3×84=25.2 g
(1)a≤15 g时,盐酸对于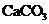 、
、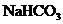 均过量,天平保持平衡的条件是:
均过量,天平保持平衡的条件是:
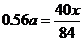 x=1.176a
x=1.176a
7、将7.28g Fe溶于过量的稀H 2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,已知其反应方程式为:
2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,已知其反应方程式为: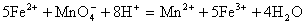 。通过计算、确定KNO3的还原产物是什么?(还原产物为氧化物)并写出其离子方程式。
。通过计算、确定KNO3的还原产物是什么?(还原产物为氧化物)并写出其离子方程式。
解析:该题中Fe已全部被转化为Fe2+,因此Fe2+与KNO3、KMnO4的氧化还原反应中,还原剂为Fe2+,氧化剂为KNO3、KMnO4,根据电子得失守恒列方程。
Fe2+失去电子的物质的量= KMnO4得到电子的物质的量+KNO3得到电子的物质的量
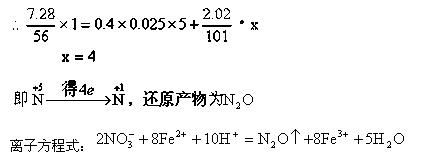
6、已知NO2与NaOH溶液反应:
3NO2+2NaOH=2NaNO3+NO+H2O,NO和NO2可一起与NaOH溶液作用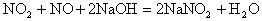 现欲用V
L
现欲用V
L 某烧碱溶液使由nmol NO和m mol NO2组成的混合气体中的氮全部进入溶液中,NaOH溶液的物质的量浓度至少为多少?
某烧碱溶液使由nmol NO和m mol NO2组成的混合气体中的氮全部进入溶液中,NaOH溶液的物质的量浓度至少为多少?
解析:NO和NO2的混合气体与NaOH溶液反应,产物为NaNO2,产物中Na+与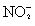 的物质的量比为1∶1,根据反应中Na+与N原
的物质的量比为1∶1,根据反应中Na+与N原 子的物质的量守恒,可列出方程。
子的物质的量守恒,可列出方程。
设NaOH溶液的物质的量浓度为x。
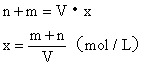
5、把过量的Fe粉投入到FeCl3和CuCl2组成的混合溶液中,充分搅拌,反应后过滤、干燥,称得不溶性物质的质量与加入铁粉的质量相等。求混合物中FeCl3和CuCl2的物质的量之比是多少?
解析:设CuCl2为xmol、FeCl3为ymol。

4、现有氧化铜和碳粉的混合物共Amol,将它在隔绝空气条件下加热,反应完全后,冷却,得到残留固体。
(1)写出可能发生反应的化学方程式
(2)若氧化铜在混合物中的量的比值为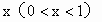
问:x为何值时,残留固体为何种物质?写出残留固体的物质的量与x值之间 的关系。将结果填入下表。
|
|
残 留 固 体 |
|
|
x值 |
分 子
式 子
式 |
物质的量 |
|
|
|
|
解析:(1)首先写出有关的化学反应方程式,根据化学方程式中有关物质间的物质的量的关系,分析当CuO恰好完全反应时,x值是多少?
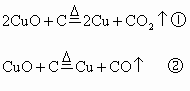
按 ①式反应,x值为
①式反应,x值为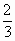 时,反应物恰好反应;按②式反应,x值为
时,反应物恰好反应;按②式反应,x值为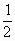 时,反应物恰好完全反应。
时,反应物恰好完全反应。
(2)当 时,CuO过量,按C的量计算。
时,CuO过量,按C的量计算。
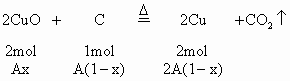
剩余CuO的物质的量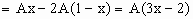
(3)当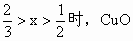 不足量,按CuO的量计算,生成铜的量为Ax。
不足量,按CuO的量计算,生成铜的量为Ax。
(4)当 时,C过量,按②式中的CuO的量计算,生成铜为Ax,剩余C的物质的量为:
时,C过量,按②式中的CuO的量计算,生成铜为Ax,剩余C的物质的量为:
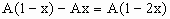
将所得结果的有关数值填入下表:
|
x 值 |
残 留 固 体 |
|
|
|
分 子 式 |
物 质 的 量 |
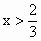 |
Cu CuO |
2A(1-x) A(3x-2) |
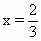 |
Cu |
Ax(或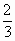 A) A) |
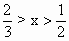 |
Cu |
Ax |
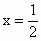 |
Cu |
Ax(或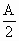 ) ) |
 |
Cu C |
Ax A(1-2x) |
3、将5.000gNaCl、NaBr、CaCl2的混合物溶于水,通入氯气充分反应,然后把溶液蒸干并灼烧,得残留物4.914g。灼烧后的残留物再溶于水,并加足量的Na2CO3溶液,所得沉淀经干燥后质量为0.270g。求混合物中各化合物的质量百分组成。
分析:根据题意可列出下图示,帮助审清题意,找出思路和解法。
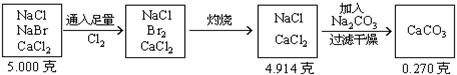
根据图示可分析:
(1)CaCO3的质量为0.270g,由它可求出CaCl2的质量。
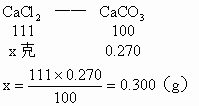
(2)混合物中通入Cl2
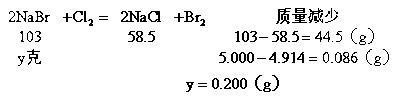
(3)NaCl的质量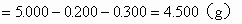
(4)各组分的百分含量
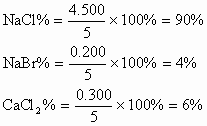
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com