
11.设阿伏加德罗常数的值为NA,下列叙述正确的是
A.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
B.0.1mol 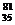 Br原子中含中子数为3.5NA
Br原子中含中子数为3.5NA
C.6.0g SiO2晶体中含有的硅氧键数目为0.4NA
D.7.8g过氧化钠中所含有的阴离子数为0.2NA
10.右图a曲线是198K时N2与H2反应过程中能量变化的示意图。下列叙述正确的 是
是
A.该反应的热化学方程式为:
N2 + 3H2 2NH3 △H =-92kJ·mol-1
2NH3 △H =-92kJ·mol-1
B.向一密闭容器中加入1molN2和3molH2充分
反应后,放出92kJ热量
C.b曲线是加入催化剂时的能量变化曲线
D.加入催化剂可增大正反应速度,降低逆反应速率
9.在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③17.6g CO2 ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度③>②>④>①
c.电子总数②>③>①>④ d.原子总数①>③>②>④
A.abcd B.bcd C.acd D.abc
8.由H2SO4、Al2O3、NaOH、Mg、Cl2两两之间进行反应,可制得的正盐有
A.5种 B.6种 C.7种 D.8种
7.某溶液中含有SO42- 、CO32-、NH4+、M,且SO42-、CO32-、NH4+离子的物质的量之比为1∶2∶4,则离子M可能是
、CO32-、NH4+、M,且SO42-、CO32-、NH4+离子的物质的量之比为1∶2∶4,则离子M可能是
A.H+ B.K+ C.Cl- D.Ba2+
6.向饱和澄清石灰水中加入生石灰,再恢复到原温度,下列说法正确的是
A.Ca2+浓度减小 B.溶剂质量减小
C.溶液质量不变 D.Ca2+数目增多
5.下列关于实验的描述不正确的是
A.使用容量瓶配制溶液时,俯视液面定容后所 得溶液的浓度偏低
得溶液的浓度偏低
B.过滤时,玻璃棒靠在三层滤纸边沿稍下方
C.在镀件上电镀铜时,可用金属铜作阳极
D.在用Fe(OH)3胶体溶液做电泳实验时,阴极区红色加深,可知Fe(OH)3胶体粒子带正电荷
4.下列实验操作正确的是
A.用带橡皮塞的棕色细口瓶盛放浓硝酸
B.滴定管经蒸馏水润洗后,即可注入标准液进行滴定
C.用干燥清洁的玻璃棒蘸取某溶液点在pH试纸中部,跟标准比色卡比较来测定该溶液的pH
D.配制溶液时加水超过容量瓶的标线,用滴管把多余的液体吸出
3.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为
A.原子晶体 B.分子晶体 C.离子晶体 D.金属晶体
2.下列化学用语表达正确的是
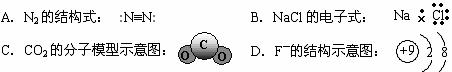
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com