
1、我国现存最大的类书是( )
A、《永乐大典》 B、《古今图书集成》 C、《四部医典》 D、《四库全书》
21、(16分)某兴趣小组为探究Cl2和SO2的化学性质,他们使用的药品和装置如图所示:
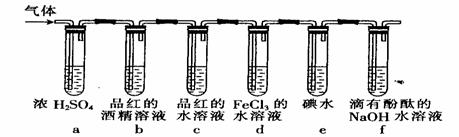
(1)实验室制取Cl2反应的离子方程式为 。
(2)当通入足量Cl2时,观察到装置中溶液褪色的有e和 (填装置序号);若装置e中装有5.0mL1.0×10-3mol·L-1碘水,当与足量Cl2完全反应后,转移了5.0×10-5mole-,则该反应的化学方程式为 。
(3)当通入足量SO2时:
①装置c中品红褪色,而装置b中品红不褪色。请你猜想使品红褪色的分子是 。(填分子式)
②装置中溶液褪色的除c之外还有 (填装置序号,下同),其中褪色原理相同的是 装置。
(4)为了探究Cl2、SO2同时通入H2O中发生的反应,该化学兴趣小组同学设计了下图所示的实验装置:
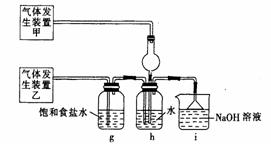
为验证通入h装置中的气体是Cl2还是SO2过量,该小组的同学准备了以下试剂:
A、硝酸银溶液 B、氢氧化钠溶液 C、碘化钾淀粉溶液
D、酸性高锰酸钾溶液 E、硫酸铜溶液
从上述试剂中选取必要的试剂,加入适量的装置h所得溶液,并写出相应的实验现象(填入下表)
|
试剂(填字母) |
实验现象 |
结论 |
|
|
|
Cl2过量 |
|
|
|
SO2过量 |
20、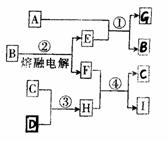 (12分)物质A-I有如图所示的转化关系,各物质的组成元素中只有一种元素是非短周期元素。其中E、G是同主族的金属单质,常温下均能与水剧烈反应,C、D、F是常见的三种非金属单质,F与D在光照条件下可发生化合反应生成18电子化合物,I是一种氮肥,A的焰色反应呈紫色。
(12分)物质A-I有如图所示的转化关系,各物质的组成元素中只有一种元素是非短周期元素。其中E、G是同主族的金属单质,常温下均能与水剧烈反应,C、D、F是常见的三种非金属单质,F与D在光照条件下可发生化合反应生成18电子化合物,I是一种氮肥,A的焰色反应呈紫色。
请回答下列问题:
(1)G的名称为 ,I的电子式为 。
(2)反应②中,阳极的电极反应式为 。
(3)反应④中若F过量,则该反应化学方程式是 。
(4)反应①中各物质的物理性质如下表:
|
|
G |
E |
A |
B |
|
熔点(0C) |
63.65 |
97.8 |
770 |
801 |
|
沸点(0C) |
774 |
882.9 |
1500(升华) |
1431 |
 根据平衡移动原理可推知,反应①的适宜温度是
(填字母)。
根据平衡移动原理可推知,反应①的适宜温度是
(填字母)。
A、97.8-7700C B、770-7740C
C、774-882.90C D、1413-15000C
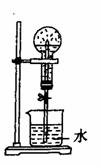
(5)在容积为V L的烧瓶中分别充入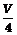 L气体F和
L气体F和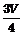 L气体H,充分反应后进行如图所示的喷泉实验,其中烧瓶中充入的液体最多占烧瓶容积的
(填数字)。
L气体H,充分反应后进行如图所示的喷泉实验,其中烧瓶中充入的液体最多占烧瓶容积的
(填数字)。
19、(12分)A、B、C、D、E为元素周期表中前三周期形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8。
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C离子的结构示意图为 ,该反应的离子方程式为 。
(2)任何水溶液中都有A、D两种离子,D离子的电子式是 。
(3)B与E结合成化合物丙,其中离子数之比为2:1,A与D结合成化合物丁,丁跟丙反应产生无色无味的气体,该反应的化学方程式为 。
(4)有一种液态氮氢化合物戊,与E的电子数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,戊的结构式为 ,8g该液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375kJ的热量,写出该反应的热化学方程式为 。
18、(10分)在一容积为2L的恒容密闭容器中加入1molA和3molB,保持温度为200C,在催化剂存在的条件下进行下列反应: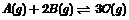 ,达平衡后生成0.5mol C,平衡混合气体中C的体积分数为ω,请回答下列问题:
,达平衡后生成0.5mol C,平衡混合气体中C的体积分数为ω,请回答下列问题:
(1)200C时,平衡混合气体中C的体积分数ω=
(2)200C,若在同一容器中加入2molA和6molB,达到平衡后,C的物质的量浓度为 ,此时平衡混合气体中C的体积分数 (填“大于”“小于”或“等于” )ω
(3)200C 时,若在同一容器中加入1molA,5molB和 molC,则平衡混合气体中C的体积分数仍为ω,平衡时体系中A的物质的量浓度为 。
17、(10分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
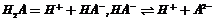 回答下列问题:(1)Na2A溶液显 (填“酸性”“中性”或“碱性”),理由是(用离子方程式表示)
回答下列问题:(1)Na2A溶液显 (填“酸性”“中性”或“碱性”),理由是(用离子方程式表示)
(2)若0.1mol/LNaHA溶液的PH=2,则0.1mol/L H2A溶液中氢离子的物质的量浓度 0.11mol/L(填“大于”“小于”或“等于”)理由是
(3)0.1mol/LNaHA溶液中各种离子浓度由大到小的顺序是 。
16、某白色固体可能含有①NH4Cl ②AlCl3 ③NaCl ④AgNO3 ⑤KOH中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞呈红色,若向溶液中加入稀硝酸至过量,有白色沉淀生成,对原固体的判断不正确的是( )
A、可能不存在② B、无法确定是否有③
C、至少存在③和⑤ D、至少存在①④⑤
15、已知常温常压下,饱和CO2的水溶液PH=3.9,可推断用标准盐酸溶液滴定NaHCO3水溶液时,适宜选用的指示剂及滴定终点时颜色变化的情况是( )
A、石蕊 由蓝变红 B、甲基橙 由黄变橙
C、酚酞 红色褪去 D、甲基橙 由黄变红
14、下列溶液中各粒子浓度关系不正确的是( )
A、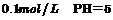 的NaHSO3溶液中,
的NaHSO3溶液中,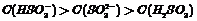
B、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合
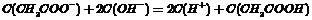
C、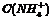 相等的
相等的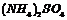 溶液、
溶液、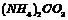 溶液、
溶液、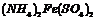 溶液和NH4Cl溶液
溶液和NH4Cl溶液
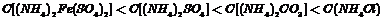
D、PH相等的CH3COONa、NaOH和Na2CO3三种溶液: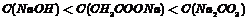
13、分别取PH=3的两种一元酸HA和HB溶液10mL,加入等量(过量)的镁粉,充分反应后,收集到H2的体积在相同状况下分别为V1和V2。下列说法中正确的是( )
A、若它们都是弱酸,则V1和V2在标准状况下一定相等。
B、若V1大于V2,则相同条件下,NaA溶液的碱性弱于NaB溶液的碱性
C、将HA和HB溶液稀释相同的倍数,若PH(HA)>PH(HB),则酸性:HA>HB
D、反应开始时HA和HB溶液的物质的量浓度不相等,二者生成H2的速率不同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com