
30.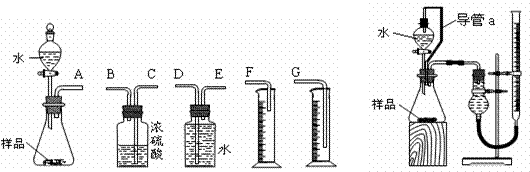 (16分)九江一中有甲、乙两个探究性学习小组,他们拟测定过氧化钠样品(含少量Na2O)的纯度。
(16分)九江一中有甲、乙两个探究性学习小组,他们拟测定过氧化钠样品(含少量Na2O)的纯度。
(1)甲组同学拟选用左图实验装置完成实验:
①写出实验中所发生反应的化学方程式__________________________________
②该组同学必须选用的装置的连接顺序是:A接( )( )接( )( )接( )
(填接口字母,可不填满。)
③实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其旋塞,一会儿后水也不能顺利滴入锥形瓶。请你帮助分析原因: _____________________________________ __。
④实验结束时,该组同学应怎样测量实验中生成的氧气的体积? 。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是:____________________________、________________________。
②若实验中样品的质量为wg,实验前后碱式滴定管中液面读数分别为V1 、V2 (换算成标况)。则样品的纯度为____________________________(含w、V的表达式)。
九江一中2010届高三年级
29.(15分)下图表示一些常见无机物之间的转化关系,其中盐C的焰色反应呈黄色:
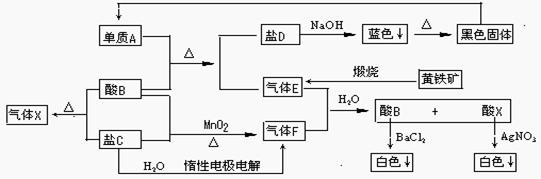
(1) 请写出下列物质的化学式:
X ____,蓝色↓
(2)写出下列反应的化学方程式
①A+B→_______________________________________________________________
②B+C+MnO2→__________________________________________________________
③黑色固体→A:_______________________________________________________
④黄铁矿→E:________________________________________________________
该反应在工业设备______________中进行。
(3) ①E+F→B+X的离子方程式为: ______________
②C+H2O F的离子方程式为:_________________________________
F的离子方程式为:_________________________________
28. (14分)已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略) ,请回答下列问题:
(14分)已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略) ,请回答下列问题:
(1)请写出F的电子式 ;
在②反应中,当生成2.24L的G(标况)时,
反应转移的电子数目为
(2)若A、C、D均含有氯元素,且A的化合价
介于C与D之间,写出稀溶液中①的离子方程式:
。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,
则A与B分别为 __________ 。(名称)
(4)若A与B均为固体化合物,C是常见的一种中性干燥剂,则反应①的化学方程式为____________________________________________________ 。
该反应生成的D气体1.7g在Pt的催化作用下和G气体反应后恢复至室温,放出热量29.25KJ,写出该反应的热化学反应方程式_______________________________________
27.(15分)有A、B、C、D四种元素,A元素的气态氢化物分子式为AH4,其中A的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫___________,其晶体类型是_____________。
(2)B的氢化物的电子式为_____________,属____________分子。(极性或非极性)
(3)A和B形成化合物的分子空间构型为___________,属_________分子(极性或非极性),其晶体类型是_________________。俗名________________。
(4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)____________________________。
(5)C和D的化合物溶于水后滴入过量KOH,现象是_____________________________,
离子方程式为________________________________________________________。
13.t℃时,将agNH3完全溶于水,得到V mL溶液,设该溶液的密度为ρg·cm-3,质量分数为ω的氨水,其中含NH4+的物质的量为b moL。下列叙述中正确的是

12.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反映为黄色。下列判断正确的是
A.氢化物的稳定性:HnX>HnW,是因为HnX 分子间存在氢键
B.原子序数:W > Y > Z >X
C.离子的还原性:X>W
D.原子及离子半径:Z>Y>X
11.下列画有横线的物质在化学反应中不能完全被消耗的是
A.含0.1molHCl的某浓盐酸与足量MnO2混合加热
B.将2.3gNa投入至100mL 0.1mol/L的盐酸中
C.将含少量CO2的CO气体通入盛有足量的Na2O2的密闭容器中,并不断用电火花引燃
D.在强光持续照射下,向过量的Ca(ClO)2悬浊液中通入少量CO2
10.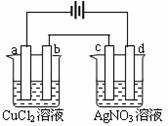 如右图,以惰性电极材料为电极对足量的两种溶液进行
如右图,以惰性电极材料为电极对足量的两种溶液进行
电解,在a、b、c、d各电极上析出生成物的物质的量比
例关系正确的是:( )
A.1:1:1:1 B.2:2:1:1
C.2:2:4:1 D.1:2:2:4
9.在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继
得到了C70、C84、C90、等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
A.熔点比较:C60<C70<C90<金刚石<石墨
B.已知C(石墨,s) C(金刚石,s);△H>0,则石墨比金刚石稳定
C(金刚石,s);△H>0,则石墨比金刚石稳定
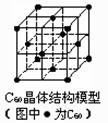
C.据右上图,C60晶体中每个C60分子周围与它距离最近且等距离的C60分子有12个
D.金刚石属原子晶体;C60、C70、管状碳属分子晶体,两类不是同素异形体
8.在常温下,发生下列几种反应:
① 16H++10Z一+2XO4一=2X2++5Z2+8H2O ② 2A2++B2=2A3++2B一 ③2B一+Z2=B2+2Z一
根据上述反应,判断下列结论中错误的是
A. 溶液中可发生:Z2+2A2+=2A3++2Z一 B.Z2在①、③反应中为还原剂
C.氧化性强弱的顺序为:XO4一>Z2>B2>A3+ D.X2十是XO4一的还原产物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com