
2.(2008· 山东理综,13)NA代表阿伏加德罗常数,下列叙述错误的是 ( )
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
 B.在H2O2+Cl2
B.在H2O2+Cl2 2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子
2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L
0.50 mol/L NH4Cl溶液与2 L 0.25 mol/L NH4Cl溶液含NH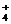 物质的量不同
物质的量不同
答案 A
[例3]相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气
体中Cl2与O2的体积比为________,混合气体的平均相对分子质量为__________。
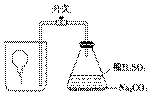 答案 1∶1 51.5
答案 1∶1 51.5
[例4]为测定气球内的气体成分,有学生用超薄材料的
气球按右图装置进行实验。开始时气球沉于烧杯底部,
打开开关后,过一会儿气球从烧杯底部慢
慢浮起,最后悬于烧杯口。气球内可能的气体是
(相对原子质量H-1、C-12、O-16、Cl-35.5) ( )
A.氧气 B.氢气 C.甲烷 D.氯气
答案 A
1.下列叙述正确的是 ( )
A.相同条件下,N2和O3的混合气与等体积的N2所含原子数相等
B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16 g CH4与18 g NH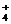 所含质子数相等
所含质子数相等
答案 B
7.下列条件下,两瓶气体所含原子数一定相等的是 ( )
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6 D.同压强、同体积的N2O和CO2
答案 AC
[例1](2008·上海,9)设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.23 g钠在氧气中完全燃烧失电子数为0.5NA
B.1 L 2 mol/L的MgCl2溶液中含Mg2+数为2NA
C.标准状况下,11.2 L的SO3所含分子数为0.5NA
D.室温下,8 g甲烷含有共价键数为2NA
答案 D
[例2](2007·上海,20)设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.常温下11.2 L的甲烷气体含有甲烷分子数为0.5NA个
B.14 g乙烯和丙烯的混合物中总原子数为3NA个
C.0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
D.5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA个
答案 B
6. 在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是
( )
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是
( )
A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2)
答案 D
5.下列叙述正确的是 ( )
A.48 g O3气体含有6.02×1023个O3分子
B.常温常压下,4.6 g NO2气体含有1.81×1023 个NO2分子
C.0.5 mol/L CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6 L H2O含有9.03×1023个H2O分子
答案 A
4.(2008·海南,3)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压
强均相同,且甲的密度大于乙的密度,则下列说法正确的是 ( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
答案 B
3.(2008· 许昌联考)下列说法正确的是 ( )
A.1 mol物质的质量就是该物质的摩尔质量
B.1 mol气体的体积就是气体的摩尔体积
C.1 mol任何粒子的粒子数叫做阿伏加德罗常数
D.1 mol HCl溶于1 L水中,所得盐酸的物质的量浓度为1 mol/L
答案 C
2.下列对“摩尔(mol)”的叙述不正确的是 ( )
A.摩尔是一个单位,用于计量物质所含微观粒子的多少
B.摩尔既能用来计量纯净物,又能用来计量混合物
C.1 mol任何气体所含的气体分子数目都相等
D.用“摩尔”(而不用“个”)计量微观粒子与用“纳米”(而不用“米”)计量原子直径,计量思路都是扩大单位
答案 D
第一章 常用化学计量
第1讲 物质的量、气体摩尔体积
1.(2008· 海南)设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
B.标准状况下,14 g氮气含有的核外电子数为5NA
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
答案 C
17.(12分)自由电子激光器是利用高速电子束射入方向交替变化的磁场,使电子在磁场中摆动着前进,进而产生激光的一种装置.在磁场中建立与磁场方向垂直的平面坐标系xoy,如图甲所示.方向交替变化的磁场随x坐标变化的图线如图乙所示,每个磁场区域的宽度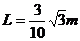 ,磁场的磁感应强度大小
,磁场的磁感应强度大小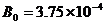 T,规定磁场方向垂直纸面向外为正方向.现将初速度为零的电子经电压
T,规定磁场方向垂直纸面向外为正方向.现将初速度为零的电子经电压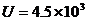 V的电场加速后,从坐标原点沿x轴正方向射入磁场.电子电荷量
V的电场加速后,从坐标原点沿x轴正方向射入磁场.电子电荷量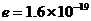 C,电子质量m取
C,电子质量m取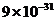 kg,不计电子的重力,不考虑电子因高速运动而产生的影响.
kg,不计电子的重力,不考虑电子因高速运动而产生的影响.
(1)电子从坐标原点进入磁场时的速度大小为多少?
(2)请在图甲中画出x=0至x=4L区域内电子在磁场中运动的轨迹,计算电子通过图中各磁场区域边界时位置的纵坐标并在图中标出;
(3)从x=0至x=NL(N为整数)区域内电子运动的平均速度多大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com