
30.(16分)体色是划分鲤鱼品种和检验其纯度的一个重要指标。不同鲤鱼品种的体色不同,是由于鱼体鳞片和皮肤含有不同的色素细胞及其数量分布差异所致。科研人员用黑色鲤鱼(简称黑鲤)和红色鲤鱼(简称红鲤)杂交,F1皆表现为黑鲤,F1自交结果如下表所示,请回答下列问题。
|
取样地点 |
取样总数 |
F2性状分离情况 |
||
|
黑鲤 |
红鲤 |
黑鲤:红鲤 |
||
|
1号池 |
1699 |
1592 |
107 |
14.88:1 |
|
2号池 |
62 |
58 |
4 |
14.50:1 |
(1)鲤鱼体色中的 是显性性状。
(2)分析实验结果推测:鲤鱼的体色是由 对基因控制的,该性状的遗传遵循
定律。
(3)为验证上述推测是否正确,科研人员又做了如下实验:
①选择纯合黑鲤鱼是纯合红鲤做亲本杂交获得F1;
②
③
预期结果 。
(4)如果 与 相符,说明上述推测成立。
29.(18分)下图表示在无机环境和生物体内碳元素的转移途径。请据图回答下列问题。
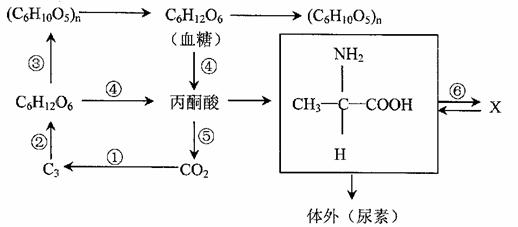
(1)①过程发生的部位是 ,完成该过程需要 。
(2)完成②过程需要 反应提供的 。
(3)植物体内通过③过程合成的有机物(C6H10O5)n包括 。
(4)过程④、⑤共同的产物是 。
(5)若X是抗体,产生此物质的细胞是 ,该细胞中完成⑥过程的场所是 。
(6)土壤中能产生脲酶的微生物可以分解尿素。因此,可以利用 的选择培养基培养分离出尿素分解菌。
28.(20分)有机化合物F是合成电子薄膜材料高聚物Z和增塑剂P的重要原料。
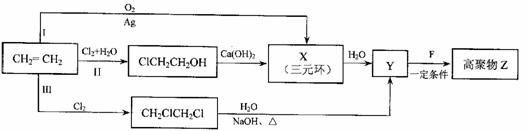 (1)某同学设计了由乙烯合成高聚物Z的3条路线(I、II、III)如下图所示。
(1)某同学设计了由乙烯合成高聚物Z的3条路线(I、II、III)如下图所示。
①3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、“II”或“III”) 。
②X的结构简式是 。
③1molF在O2中充分燃烧,生成CO2和H2O的物质的量之比为8:3,消耗7.5molO2,其核磁共振氢谱中的3个吸收峰,且能与NaHCO3反应生成CO2。F分子中含有的含氧官能团的名称是 。
Y+F→Z反应的化学方程式是 。
(2)已知: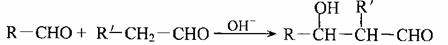
(R、R′代表烃基或氢原子)
合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3。
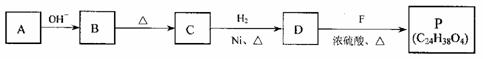
①A→B反应的化学方程式是 。
②B→C的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氢原子。C的结构简式是 。
③P的结构简式是 。
④符合下列条件的B的同分异构体共有(填数字) 种。
a. 在酸性条件下水解为M和N b. 一定条件下M可以转化为N
⑤已知:RCH=CHCHO+H2 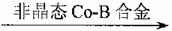 RCH=CHCH2OH
RCH=CHCH2OH
(R代表烃基或氢原子)
A的同系物W的相对分子质量为44。请参照示例写出以W和另一种有机物为原料合成肉桂醇(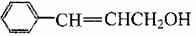 )的合成路线:
。
)的合成路线:
。
(示例:反应物 产物 产物2……)
27.(14分)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。
甲+乙→丙+丁
(1)转化关系中所涉及的反应为非氧化还原反应,且乙为水。
①若甲为块状固体,丙为可燃性气体,其分子内既含有极性键又含有非极性键。则丙的电子式是 。
 ②若甲是由N和Cl元素组成的化合物,其分子结构模型如右图所示,丙具有漂白性。则甲中Cl元素的化合价是 。
②若甲是由N和Cl元素组成的化合物,其分子结构模型如右图所示,丙具有漂白性。则甲中Cl元素的化合价是 。
(2)转化关系中所涉及的反应为氧化还原反应,且乙为水。
①若甲和丙是同主族元素组成的单质,且组成甲的元素
位于第三周期,此反应的离子方程式是 。
②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是 。
 ③若甲是由N和O元素且成的气态物质,呈红棕色。将3.36g Fe加到一定量丙溶液中,收集到1.12L气体丁(已折算为标准状况),则反应的离子方程式是
。
③若甲是由N和O元素且成的气态物质,呈红棕色。将3.36g Fe加到一定量丙溶液中,收集到1.12L气体丁(已折算为标准状况),则反应的离子方程式是
。
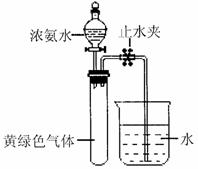
(3)Hofmann依据上述转化关系测定氨分子的组
成。现用如右图所示的装置进行实验,打止
分液漏斗的活塞,滴下浓氨水,至不再反应
为止;关闭分液漏斗的活塞,待恢复到室温,
打开止水夹,试管内液面上升至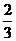 处。
处。
①滴下浓氨水一段时间后,试管内发生反应的
化学方程式是 。
②证明试管内“不再反应”的实验操作和现象是 。
26.(10分)
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
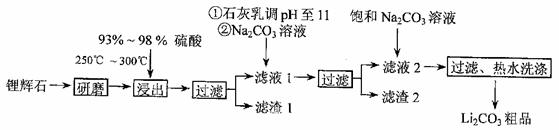
已知:①Li2O·Al2O3·4SiO2+H2SO4(浓)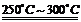 Li2SO4+Al2O3·4SiO2·H2O↓②某些物质的溶解度(S)如下表所示。
Li2SO4+Al2O3·4SiO2·H2O↓②某些物质的溶解度(S)如下表所示。
|
T/℃ |
20 |
40 |
60 |
80 |
|
S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
|
S(Li2CO3)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣I中分离出Al2O3部分的流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤II中反应的离子方程式是 。
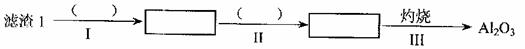
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。
向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a. 将Li2CO3溶于盐酸作电解槽的阳液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b. 电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
25.(14分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应2H2O 2H2O+O2↑可制备氧气。
2H2O+O2↑可制备氧气。
①取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
|
序号 |
条件 |
现象 |
结论 |
|||
|
温度/℃ |
催化剂 |
|||||
|
1 |
40 |
FeCl3溶液 |
|
|
||
|
2 |
20 |
FeCl3溶液 |
|
|
||
|
3 |
20 |
MnO2 |
|
|
||
|
4 |
20 |
无 |
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
②实验室用MnO2做该反应的催化剂,使用如右图所示
装置的A部分制备O2,避免反应过于剧烈的操作是
。
(2)Na2O2与水反应也可生成O2。某同学取4g Na2O2样品与过量水反应,待反应完全终止时,得100mL溶液X和448mLO2(已折算为标准状况)。该同学推测样品中含有杂质或反应中生成H2O2,并进行实验研究。
①取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀。则反应了离子方程式是 。
②通过如下图所示整套实验装置测定Na2O2样品的纯度,假设所含杂质不参加反应。取25mLX,滴入烧瓶内使其与过量KMnO4酸性溶液反应,最终生成56mLO2(已折算为标准状况),则此样品中Na2O2的质量分数是 。
24.(20分)
在如图所示的x – o – y 坐标系中,y>0的区域内存在着沿y轴正方向、场强为E的匀强电场,y<0的区域内存在着垂直纸面向里、磁感应强度为B的匀强磁场。一带电粒子从y轴上的P(0,h)点以沿x轴正方向的初速度射出,恰好能通过x轴上的D(d,0)点。已知带电粒子的质量为m,带电量为-q。h、d、q均大于0。不计重力的影响。
(1)若粒子只在电场作用下直接到达D点,求粒子初速度的大小v0;
(2)若粒子在第二次经过x轴时到达D点,求粒子初速度的大小v0;
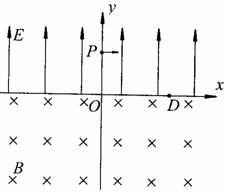 (3)若粒子在从电场进入磁场时到达D点,求粒子初速度的大小v0;
(3)若粒子在从电场进入磁场时到达D点,求粒子初速度的大小v0;
23.(18分)
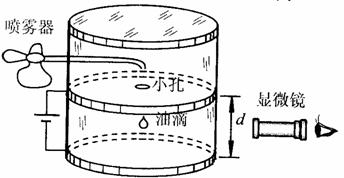
1897年汤姆逊发现电子后,许多科学家为测量电子的电荷量做了大量的探索。1907-1916年密立根用带电油滴进行实验,发现测滴所带的电荷量是某一数值e的整数倍,于是称这一数值e为基本电荷。
如图所示,完全相同的两块金属板正对着水平放置,板间距离为d。当质量为m的微小带电油滴在两板间运动时,所受空气阻力的大小与速度大小成正比。两板间不加电压时,可以观察到油滴竖直向下做匀速运动,通过某一段距离所用时间为t1;当两板间加电压U(上极板的电势高)时,可以观察到同一油滴竖直向上做匀速运动,且在时间t2内运动的距离与在时间t1内运动的距离相等。忽略空气浮力。重力速度为g。
(1)判断上述油滴的电性,要求说明理由;
(2)求上述油滴所带的电荷量Q;
(3)在极板间照射X射线可以改变油滴的带电量。再采用上述方法测量油滴的电荷量。如此重复操作,测量出油滴的电荷量Qi如下表所示。如果存在基本电荷,请根据现有数据求出基本电荷的电荷量e(保留到小数点后两位)。
|
实验次序 |
1 |
2 |
3 |
4 |
5 |
|
电荷量 Qi(10-18C) |
0.95 |
1.10 |
1.41 |
1.57 |
2.02 |
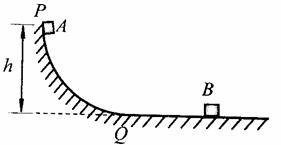
22.(16分)
如图所示,竖直平面内的光滑弧形轨道的底端恰好与光滑水平面相切。质量为M=2.0kg的小物块B静止在水平面上。质量为m=1.0kg的小物块A从距离水平面高h=0.45m的P点沿轨道从静止开始下滑,经过弧形轨道的最低点Q滑上水平面与B相碰,碰后两个物体以共同速度运动。取重力加速度g=10m/s2。求
(1)A经过Q点时速度的大小v0;
(2)A与B碰后速度的大小v;
(3)碰撞过程中系统(A、B)损失的机械能△E。
21.(18分)
(1)某班同学在做“练习使用多电表”的实验。
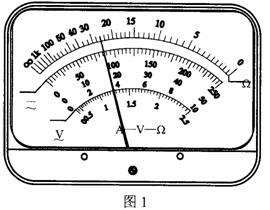 ①某同学用多用电表的欧姆挡测量电阻Rx的阻值,当选择开关置于欧姆挡“×100”的位置时,多用电表指针示数如图1所示,此被测电阻的阻值约为 Ω。
①某同学用多用电表的欧姆挡测量电阻Rx的阻值,当选择开关置于欧姆挡“×100”的位置时,多用电表指针示数如图1所示,此被测电阻的阻值约为 Ω。
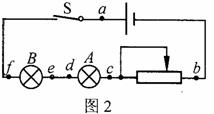 ②某同学按如图2所示的电路图连接元件后,闭合开关S,发现A、B灯都不亮。该同学用多用电表的欧姆挡检查电路的故障。检查前,应将开关S
(选填“闭合”或“断开”)
②某同学按如图2所示的电路图连接元件后,闭合开关S,发现A、B灯都不亮。该同学用多用电表的欧姆挡检查电路的故障。检查前,应将开关S
(选填“闭合”或“断开”)
③若②中同学检查结果如表所示,由此可以确定 ( )
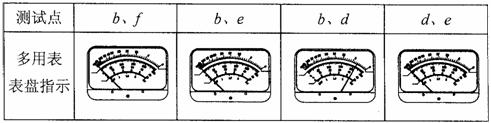
A.灯A断路 B.灯B断路
C.灯A、B都断路 D.d、e间导线断路
(2)某同学采用如图3所示的装置验证规律:“物体质量一定,其加速度与所受合力成
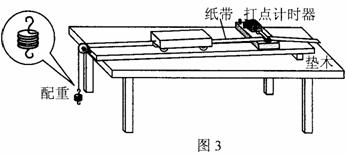 正比”
正比”
a. 按图3把实验器材安装好,不挂配重,反复移动垫木直到小车做匀速直线运动
b. 把细线系在小车上并绕过定滑轮悬挂配重,接通电源,放开小车,打点计时器在被小车带动的纸带上打下一系列点,取下纸带,在纸带上写上编号;
c. 保持小车的质量M不变,多次改变配重的质量m,再重复步骤b;
d. 算出每条纸带对应的加速度的值;
e. 用纵坐标表示加速度a,横坐标表示配重的重力mg(作为小车受到的合力F),作出a – F 图象。
①在步骤d中,该同学是采用v – t 图象来求加速度的。图4为实验中打出的一条纸带的一部分,纸带上标出了连续的3个计数点,依次为B、C、D,相邻计数点之间还有4个计时点没有标出。打点计时器接在频率为50Hz的交流电源上。打点计时器打C点时,小车的速度为 m/s;
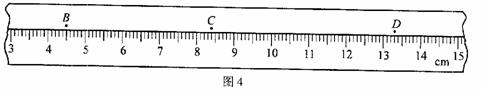
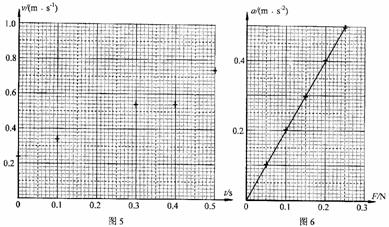 ②其余各点的速度都标出了v – t坐标系中,如图5所示。t = 0.10s时,打点计时器恰好打B点。请你瘵①中所得结果标在图5所示的坐标系中,并作出小车运动的v – t 图线;利用图线求出小车此次运动的加速度a = m/s2;
②其余各点的速度都标出了v – t坐标系中,如图5所示。t = 0.10s时,打点计时器恰好打B点。请你瘵①中所得结果标在图5所示的坐标系中,并作出小车运动的v – t 图线;利用图线求出小车此次运动的加速度a = m/s2;
③最终该同学所得小车运动的a – F图线如图6所示,从图中我们看出图线是一种经过原点的直线。根据图线可以确定下列说法中不正确的是 ( )
A.本实验中小车质量一定时,其加速度与所受合力成正比
B.小车的加速度可能大于重力加速度g
C.可以确定小车的质量约为0.50kg
D.实验中配重的质量m远小于小的质量M
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com