
2、下列对梭伦改革后的雅典公民大会的表述不正确的是 ( )
A、有权决定战争 B、有权选举国家公职人员
C、成为事实上的国家最高权力机关 D、享有最高的司法裁判权
1、在走上民主政治过程中下列事件或现象的历史发展顺序是 ( )
①梭伦改革 ②伯利克里执政 ③贵族政治 ④克里斯提尼改革
A、①②③④ B、③①④② C、③①②④ D、②①③④
23.(10分)(1)将6.62 g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80 g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00 t生铁(含铁96%),至少需要这种铁矿石________吨。(保留两位小数)
(2)取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224 mL(标准状况)。
① 计算此钢样粉末中铁和碳的物质的量之比______________。
② 再取三份不同质量的钢样粉末分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入钢样粉末的质量/g |
2.812 |
5.624 |
8.436 |
|
生成气体的体积/L(标准状况) |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度为_______________________。
③ 若在实验Ⅱ中继续加入m g钢样粉末,反应结束后剩余的固体质量可能为__________________________________________________________________________ 。(用含m的代数式表示)
21.(8分)资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
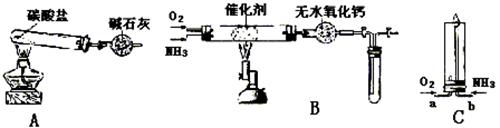
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是 ;碱石灰的作用是 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热。
停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,请回答试管内产生的现象,并结合化学方程式说明原因
。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
① 两气体通入的先后顺序是 。
其理由是 。
② 氨气燃烧的化学方程式是 。22.(11分)下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,O是生活中最常见的化合物,I常用作干燥剂。
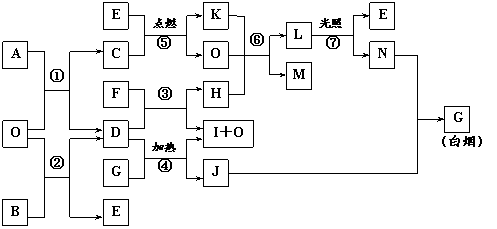
请按要求填空:
⑴G的电子式是_______________;
⑵反应⑥的化学方程式是_____________________________________________,
反应⑤在空气中发生时的现象是___________________________________________,
已知C的燃烧热是1300 kJ·mol-1,表示C的燃烧热的热化学方程式是_______________________ _________________。
⑶写出通电电解I的浓溶液的离子方程式:_____________________________________。
⑷根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是_________。
20.(9分)同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。D单质在F单质中燃烧可能生成两种化合物。请回答下列问题:
(1)判断D元素的元素符号: 。
(2)EF2的结构式 ;B元素与F元素形成化合物的电子式 。
(3)C单质与A的最高价氧化物的水化物的反应方程式:
。
(4)A的过氧化物与E的氢化物以3︰1的物质的量之比在水溶液中恰好完全反应,有淡黄色沉淀生成,写出该反应的离子方程式:
。
19.Ⅰ.(7分)(1)有两组物质:①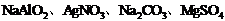 ;②Na2SO4、MgCl2、Al2(SO4)3、NH4Cl均能用一种试剂区别,区别①的试剂是 ;区别②的试剂是 。
;②Na2SO4、MgCl2、Al2(SO4)3、NH4Cl均能用一种试剂区别,区别①的试剂是 ;区别②的试剂是 。
(2)除去FeCl2中的FeCl3杂质,可使用____ __试剂,然后进行____ 分离;除去FeCl3中含有的FeCl2杂质,可使用____ __试剂;除去SiO2中含有的CaO杂质,可使用_____ 试剂;除去Na2CO3粉末中含有的NaHCO3,可使用____ __方法.(写文字)
Ⅱ.(4分)设计简单实验说明下列物质的氧化性由强到弱:Cl2>FeCl3>I2,可选用的药品有:氯水、FeCl3溶液、碘水、KI溶液、NaOH溶液、稀硫酸、盐酸、KSCN溶液、碘化钾淀粉溶液、FeCl2溶液、H2O2等。所需仪器自由选择。简述实验步骤、现象、结论。
(1)________________________________________________________________________。
(2)________________________________________________________________________。
Ⅲ.(5分)化合物BrFx与水按物质的量之比3∶5发生反应,其产物为溴酸、氢氟酸、单质溴和氧气。
(1)该反应的化学方程式是:________________________________________________。
(2)此反应中的氧化剂是______________还原剂是_____________________。
18.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
A.K+一定存在 B.100 mL溶液中含0.01 mol CO32-
C.Cl-一定存在 D.Ba2+一定不存在,Mg2+可能存在
第Ⅱ卷 填空题(共54分)
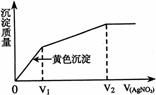
17.往含I-和Cl-的稀溶液中滴人AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中
c(I-)/c(Cl-)的比值为
A.(V2-V1)/V1 B.V1/V2 C.V1/(V2-V1) D.V2/V1
16.现有200 mLMgCl2和AlCl3的混合溶液,其中Mg2+的浓度为0.2 mol/L,Cl-浓度1.3 mol/L,要使镁离子转化为Mg(OH)2,并使Mg2+和Al3+分离开来,至少需要4 mol/L的NaOH溶液体为
 A.140 mL B.120 mL C.100 mL D.80 mL
A.140 mL B.120 mL C.100 mL D.80 mL
15.X、Y、M、N都是含钠元素的化合物,它们分别与硫酸或氢氧化钠溶液反应,表示如下:
①X+H2SO4→M+V↑ ②Y+H2SO4→M+U↑+H2O ③ V+U→W(淡黄色)+H2O ④X+Y+H2SO4→M+W↓(淡黄色)+H2O ⑤N+NaOH→M+H2O
则下列判断不正确的是
A.X一定是Na2S B.Y可能是Na2SO3
C.M一定是Na2SO4 D.N一定是NaHSO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com