
联系第二次世界大战的知识,回答5-10题。
5、1940年12月,罗斯福发表“炉边谈话”时说:“过去两年的经验已无可怀疑的证明,任何国家都不能姑息纳粹……。一个国家只能以彻底投降为代价才能与纳粹和平。”下列哪个国家的事实最终证明了罗斯福的论断?
A.法国 B.英国 C.波兰 D.西班牙
6、第二次世界大战爆发的根本原因是
A.德意日法西斯专政的建立 B.英法美推行绥靖政策
C.资本主义政治经济发展不平衡
D.德意日对凡尔赛-华盛顿体系不满
7、二战期间,各大战场发生转折的先后顺序应为 ①苏德战场 ②北非战场 ③太平洋战场 ④中国战场
A.①②③④ B.④③①② C.③②①④ D.③①②④
8、罗斯福说:德日“把不帮助轴心国的一切民族和国家都当作全体轴心国的共同敌人,这就是他们简单明确的总战略。所以只有类似的总战略才能抗衡它。”类似的总战略是
A.美国对德日宣战 B.美英发表《大西洋宪章》
C.美英愿意帮助苏联 D.所有反法西斯的国家结成联盟
9、二战期间,美国研制原子弹并用于实战,德国研制成功远程液体燃烧火箭用于空袭英国,1946年美国投入使用的第一台电子计算机最初是用来计算炮弹弹道的。这说明
A.科技是决定战争胜负的关键因素
B.二战客观上加速了第三次科技革命的到来
C.战争是推动科技发展的第一动力
D.科技新发明都是从研制新式武器开始的
10、美国在两次世界大战中的相似表现有 ①曾以“中立”地位大发战争财 ②为捞取战利品而决定参战 ③美国参战更加说明战争是帝国主义战争 ④美国参战加速了战争结束
A、①④ B、②③ C、①③ D、②④
十月革命后,苏俄实行了“战时共产主义政策”,使苏维埃政权得到巩固;从1921年开始,新经济政策开始逐步取代“战时共产主义政策”。据此回答1-4题。
1、战时共产主义政策是特殊历史条件下的产物,这里的“特殊历史条件”包括 ①国内外反动势力过于强大 ②俄国处在帝国主义战争状态 ③俄国的相对落后贫困 ④巩固苏维埃政权是最重要的任务
A.①②③ B、①③④ C、①④ D、①②③④
2、之所以称战时共产主义政策为“共产主义”政策,主要是由于
A.俄国物质文明极端发达 B、取消市场经济和商品货币关系
C.实行计划经济,按劳分配
D、最大限度的集中财力、物力,按需分配
3、新经济政策主要“新”在
A.粮食税代替余粮征集制 B、允许资本家兴办中小企业 C.允许自由贸易,实行按劳分配 D、利用商品货币关系扩大生产
4、有人称新经济政策上“布尔什维克转向资本主义”;有人说美国罗斯福新政是“社会主义计划经济”;这两种看法的共同缺陷是 ①没有从政策实施的根本目的上看问题 ②没有看到政策仅是在一定限度内调整 ③只看到政策引起的直接的、表面的变化 ④没有从发展的、辩证的角度分析问题
A.①②③ B.①②④ C.①②③④ D.①③④
23. (16分)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料。已知CuSO4·5H2O的部分结构可表示如下:
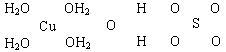
(1)写出铜原子价电子层的电子排布式____________,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有__________(填元素符号)。
(2)请在上图中把CuSO4·5H2O结构中的化学键用短线“--”表示出来。
(3)往浓CuSO4溶液中加入过量较浓的NH3·H2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液。小心加入约和溶液等体积的C2H5OH并使之分成两层,静置。经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是______________________________________________。
(4)Cu(NH3)4SO4·H2O晶体中呈正四面体的原子团是______________,杂化轨道类型是sp3的原子是____________________________。
(5)如将深蓝色溶液加热,可能得到什么结果?________________________________。
⑹把CoCl2溶解于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl。请写出表示此配合物结构的化学式(钴的配位数为6)___________,此配合物中的Co化合价为__ ____。
22.(12分)过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ. 二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
 A.苯与B3N3H6互为等电子体
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
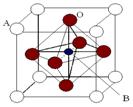
Ⅱ. 2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
⑴用A、B、O表示这类特殊晶体的化学式: 。
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。(用含x的代数式表示)
⑶Mn的外围电子轨道表示式为: 。
⑷下列有关说法正确的是 。
 A.镧、锰、氧分别位于周期表f、d、p区
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如右图:
D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
21.(8分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
 (1)比较下列两组物质的熔点高低(填“>”或“<”
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
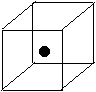
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g) 该反应的反应热△H = kJ/mol.
20.(12分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为_____ _____;
(2)写出与H2O分子互为等电子体的微粒__ ________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_ ____
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__ ___(请用相应的编号填写)
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:
。
19.(10分)m、n、x、y四种主族元素在周期表里的相对位置如下图所示。
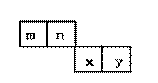 已知它们的原子序数总和为46,则:
已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的分子式为 ,
空间构型为 。
(2)m与y所形成的化合物含 键,
属 分子。(填“极性”或“非极性”)
(3)x位于周期表的第 周期,第 族;其原子结构示意图为 。
(4)由n、y的氢化物相互作用所生成的物质的电子式为 ,此物质在固态时属于 晶体。
18. (7分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。
(2) 写出C元素基态原子的电子排布式_________________________。
(3) 用轨道表示式表示D元素原子的价电子构型____________________。
(4) 元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填“>”、“<”或“=”)
17.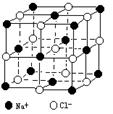 (7分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
(7分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为V cm3。
(1)步骤①中仪器A最好使用 (填序号)。
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是用 滴定管,能否用水代替苯 ,理由是
。
(3)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如上图),则用上述方法测得的阿佛加德常数NA的表达式为 。
16.据报道,某种合金材料有较大的储氢容量,其晶体结构
的最小单元如右图所示。则这种合金的化学式为 ( )
A.LaNi6 B.LaNi3 C.LaNi4 D.LaNi5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com