
3.酸碱盐反应特例ABC
⑴酸与碱:一般来说,酸与碱发生中和反应生成盐和水。但下列情况例外:
①酸碱之间的氧化还原反应,如2Fe(OH)3+6HI 2FeI2+I2+6H2O;
2FeI2+I2+6H2O;
3Fe(OH)2+10HNO3==3Fe(NO3)3+NO↑+8H2O。
②某些有机反应,如:HCOOH+2Cu(OH)2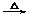 Cu2O↓+CO2↑+3H2O。
Cu2O↓+CO2↑+3H2O。
⑵酸与盐:一般来说,酸与盐反应生成新酸和新盐。但下列情况例外:
①酸与盐之间的氧化还原反应,如:2FeCl3+H2S==2FeCl2+S↓+2HCl;
Na2S2O3+H2SO4==Na2SO4+SO2↑+S↓+H2O。
②酸与盐之间的化合,如:Ca3(PO4)2+4H3PO4==3Ca(H2PO4)2。
⑶酸与酸:一般来说,两种酸之间不发生反应,但具有强还原性的酸与具有强氧化性的酸之间却能发生反应。如:2H2S+H2SO3==3S↓+3H2O;
H2S+H2SO4(浓)==S↓+SO2↑+2H2O;3H2S+2HNO3(稀)==3S↓+2NO↑+4H2O;
HClO+H2SO3=H2SO4+HCl。
⑷碱与盐:碱与盐反应一般生成新碱和新盐,但下列情况例外:
①碱与酸式盐转化成正盐。如:2NaOH+Ca(HCO3)2==CaCO3↓+Na2CO3+2H2O;
⑵过量强碱与铝盐反应转化成偏铝酸盐。如:4NaOH+AlCl3==NaAlO2+3NaCl+2H2O。
⑸碱与碱:碱与碱一般不发生反应,但形成配位化合物例外,如:
Cu(OH)2+4NH3·H2O ==(Cu(NH3)4)(OH)2+4H2O;
AgOH+2NH3·H2O ==(Ag(NH3)2)OH+2H2O。
⑹盐与盐:盐与盐反应,一般生成两种新盐,但下列情况例外:
①两种盐之间的氧化还原反应,如2FeCl3+2KI==2FeCl2+2KCl+I2。
②两种易水解盐之间的反应,如:2FeCl3+3Na2CO3+3H2O ==6NaCl+2Fe(OH)3↓+3CO2↑;
AlCl3+3NaAlO2+6H2O ==4Al(OH)3↓+3NaCl。
③易水解的盐与不溶性的盐之间的反应,
如2FeCl3+3CaCO3+3H2O ==3CaCl2+2Fe(OH)3↓+3CO2↑;
2NH4Cl+BaCO3==2NH3↑+BaCl2+CO2↑+H2O。
④强酸的酸式盐与弱酸盐之间的反应,如2NaHSO4+Na2CO3==2Na2SO4+CO2↑+H2O。
⑤多元弱酸的正盐与其酸式盐之间的反应,如Na3PO4+NaH2PO4==2Na2HPO4。
2.物质组成的七种表示方法
|
表示方法 |
定义 |
实例 |
|
电子式 |
在元素符号周围用小黑点(或×)来表示原子的最外层电子的式子叫电子式 |
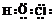 、 、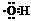 、 、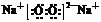 |
|
原子结构示意图 |
体现核外电子分层排布的示意图。其中 表示原子核,弧线表示电子层,弧线上的数字表示该电子层上的电子数 表示原子核,弧线表示电子层,弧线上的数字表示该电子层上的电子数 |
F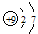 、Fe 、Fe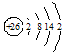 |
|
分子式(化学式) |
用元素符号来表示物质组成的式子叫化学式。能表示物质的分子组成的化学式叫分子式 |
NaCl、 C5H12 (化学式) (分子式) |
|
结构式 |
表示物质内部结构中各元素原子的排列和结合方式的化学式,原子之间的共用电子对用“-”表示,且化合物中所有的共价键都须表示出来。 |
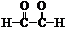 |
|
结构简式 |
将结构中的“短线”省去,并把相同的原子或原子团合写在一起的图式。 |
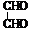 |
|
键线式 |
分子中的碳、氢原子一律不写出,一个拐点或一个顶点,就是一个碳原子,除碳、氢外,其它原子或官能团都要写出。 |
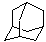 、 、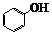 |
|
实验式(最简式) |
组成物质最简单的原子个数整数比的化学式。最简式在有机物中应用最多。 |
CH2O是甲醛、葡萄糖的最简式。 |
说明:简单阳离子的电子式与化学式相同,如Ca2+,阴离子和复杂阳离子的电子式必须带“[ ]”并且表明所带的电荷数,如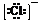 、
、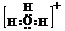 。
。
1.“四同”与“四异”概念的比较
|
四同 |
同位素 |
同素异形体 |
同系物 |
同分异构体 |
|
研究的对象 |
单核核素(原子) |
单质 |
有机物 |
化合物 |
|
判断依据 |
质子数、中子数 |
组成结构 |
官能团,-CH2- |
分子式、结构 |
|
四异 |
根 |
基 |
原子团 |
官能团 |
|
定义 |
带电的原子或原子团 |
分子中失去中性原子或原子团剩余的部分 |
多原子组成的根或基 |
决定有机物化学特性的原子或原子团 |
|
电性 |
带电 |
中性不带电 |
带电或中性 |
中性不带电 |
|
实例 |
Na+、NH4+、SO42- |
-CH3、-OH |
NH4+、-OH |
-OH、-CHO |
说明:“根”、“基”、“官能团”均属于原子或原子团,其中“根”是带电荷的原子或原子团,而“基”、“官能团”是电中性的原子或原子团,且“官能团”是特殊的“基”。其次是“根”与“基”之间存在相互的联系,如氢氧根(OH-)失去一个电子就可以转化为羟基(-OH),而羟基获得一个电子也就转化为氢氧根。
2.新高考淡化纯数字运算,强化化学思维方法考查成为命题新动向,有计算因子,就能联系阿伏加德罗常数,所以以NA为中心化学基本计量必将在化学试卷中高频率“出镜”。
[知识交汇]
1.化学用语是描述化学变化最简洁的化学语言,因此对化学用语的理解和运用是构成化学解题能力的基础。新高考命题趋势是降低知识难度,加强学科特色考查,化学用语是学习化学的工具,必将持久地受到新高考关注,其重点是电子式的书写。
(一)基本概念
免疫调节、免疫系统、免疫器官、胸腺、骨髓、免疫细胞、吞噬细胞、淋巴细胞、T细胞、B细胞、免疫活性物质、抗体、淋巴因子、溶菌酶;第一道防线、第二道防线、第三道防线、非特异性免疫、特异性免疫;抗原、体液免疫、浆细胞;细胞免疫、靶细胞、效应T细胞、宿主细胞;过敏反应、自身免疫病;疫苗、器官移植。
|

 免疫系统的组成
免疫系统的组成
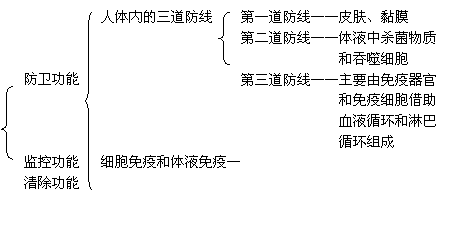
免疫系统的功能


免疫学的应用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com